题目内容
1.在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液(含有Fe2+、Fe3+、Cu2+)处理和资源回收很有意义.分析下面两种处理方案,回答下列问题:Ⅰ、利用废液再生刻蚀液
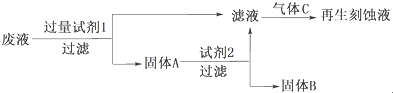
(1)试剂2是HCl,固体B是Cu,通入的气体C是Cl2.(填化学式)
(2)写出加入试剂1发生反应的离子方程式:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu.
Ⅱ、利用废液制备CuCl2•2H2O晶体
已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀的pH | 2.7 | 5.4 | 8.1 |
| 沉淀完全的pH | 3.7 | 6.9 | 9.6 |

(1)为确保产品的纯度,试剂1为B,试剂2为D(填字母).
A.KMnO4 B.H2O2 C.NaOH D.Cu2(OH)2CO3
(2)固体A的化学式为Fe(OH)3.为使A完全沉淀,调节pH的范围是[3.7,5.4).
(3)操作Ⅰ依次为加热浓缩、冷却结晶、过滤.操作Ⅰ整个过程中用到的硅酸盐仪器除了漏斗、烧杯、酒精灯外,还需要蒸发皿、玻璃棒.
(4)使用无水乙醇代替水进行洗涤的优点是减少CuCl2•2H2O 因溶于水而损失,且有利于后续干燥.
分析 Ⅰ.利用废液再生FeCl3刻蚀液,应除去溶液中的Cu2+,废液与过量的Fe反应置换出Cu,过滤,固体A为Cu与Fe的混合物,滤液中溶质为FeCl2,固体A与盐酸反应生成FeCl2,过滤除去Cu,FeCl2用氯气氧化得到FeCl3;
Ⅱ.废液含有Fe2+、Fe3+、Cu2+,制备CuCl2•2H2O晶体,应将Fe2+、Fe3+除去,由离子开始沉淀及沉淀完全的pH可知,通过调节溶液pH进行除去,整个过程不能引入新杂质,废液中加入过量的H2O2,将Fe2+氧化为Fe3+,再调节溶液pH3.7~5.4之间,使Fe3+转化为Fe(OH)3沉淀,过滤沉淀,试剂2可以为CuO、Cu(OH),CuCO3,Cu2(OH)2CO3,滤液经过加热浓缩、冷却结晶、过滤得到氯化铜晶体,由于氯化铜易溶于水,用酒精洗涤,可以减少CuCl2•2H2O 因溶于水而损失,酒精易挥发,有利于后续干燥.
解答 解:Ⅰ.利用废液再生FeCl3刻蚀液,应除去溶液中的Cu2+,废液与过量的Fe反应置换出Cu,过滤,固体A为Cu与Fe的混合物,滤液中溶质为FeCl2,固体A与盐酸反应生成FeCl2,过滤除去Cu,FeCl2用氯气氧化得到FeCl3;
(1)由上述分析可知,试剂2是HCl,固体B是Cu,通入的气体C是Cl2,
故答案为:HCl;Cu;Cl2;
(2)加入试剂1发生反应的离子方程式:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu,
故答案为:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu;
Ⅱ.废液含有Fe2+、Fe3+、Cu2+,制备CuCl2•2H2O晶体,应将Fe2+、Fe3+除去,由离子开始沉淀及沉淀完全的pH可知,通过调节溶液pH进行除去,整个过程不能引入新杂质,废液中加入过量的H2O2,将Fe2+氧化为Fe3+,再调节溶液pH3.7~5.4之间,使Fe3+转化为Fe(OH)3沉淀,过滤沉淀,试剂2可以为CuO、Cu(OH),CuCO3,Cu2(OH)2CO3,滤液经过加热浓缩、冷却结晶、过滤得到氯化铜晶体,由于氯化铜易溶于水,用酒精洗涤,可以减少CuCl2•2H2O 因溶于水而损失,酒精易挥发,有利于后续干燥.
(1)为确保产品的纯度,试剂1的目的是将Fe2+氧化为Fe3+,H2O2还原生成水,不引入新杂质,KMnO4会引入钾离子等杂质,故选H2O2,
试剂2是调节溶液pH,使Fe3+转化为Fe(OH)3沉淀而除去,氢氧化钠会引入钠离子,Cu2(OH)2CO3可以消耗氢离子,且不引入杂质,故选Cu2(OH)2CO3,
故答案为:B;D;
(2)由上述分析可知,固体A的化学式为Fe(OH)3.由离子开始沉淀及沉淀完全的pH可知,为使A完全沉淀,调节pH的范围是[3.7,5.4),
故答案为:Fe(OH)3;[3.7,5.4);
(3)操作Ⅰ是从溶液中获得氯化铜晶体,操作依次为加热浓缩、冷却结晶、过滤.操作Ⅰ整个过程中用到的硅酸盐仪器除了漏斗、烧杯、酒精灯外,还需要蒸发皿、玻璃棒,
故答案为:加热浓缩;蒸发皿、玻璃棒;
(4)使用无水乙醇代替水进行洗涤的优点是:减少CuCl2•2H2O 因溶于水而损失,且有利于后续干燥,
故答案为:减少CuCl2•2H2O 因溶于水而损失,且有利于后续干燥.
点评 本题考查物质制备方案、物质分离提纯综合应用,侧重考查学生对原理、试剂、操作的分析评价,是对学生综合能力的考查,难度中等.

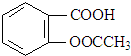
| A. | 阿司匹林的分子式为C9H8O4 | |
| B. | 阿司匹林苯环上的一氯取代物有2种 | |
| C. | 阿司匹林能与NaHCO3溶液反应,最多能与5 mol H2发生加成反应 | |
| D. | 1 mol 阿司匹林与足量NaOH溶液反应,最多消耗NaOH的量为2 mol |
| A. | pH=1的溶液中:Na+、Fe2+、NO3-、SO42- | |
| B. | 含Fe3+的溶液中:K+、Mg2+、S2-、NO3- | |
| C. | pH=13的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 强碱性溶液中:K+、Al3+、Cl-、SO42- |
| A. | 56g铁被氧化时,失去电子数目一定是2NA | |
| B. | 常温常压下,71g Cl2中含电子总数为34NA | |
| C. | 标准状况下,2.24L SO3中,含分子总数为0.1NA | |
| D. | CnH2n+2分子中含有共价键数为(3n+1)NA |
| A. | 盐酸 | B. | 氢氟酸 | C. | 烧碱 | D. | 饱和食盐水 |
| A. | 液化石油气和天然气的主要成分都是甲烷 | |
| B. | 糖类、脂类、蛋白质都属于天然高分子化合物 | |
| C. | 汽油、煤油、植物油均为含碳氢氧三种元素的化合物 | |
| D. | 误服重金属盐,立即服用牛奶或豆浆可解毒 |
 .
.
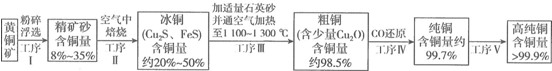
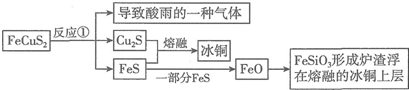
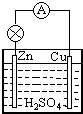 原电池是直接把化学能转化为电能的装置.如图所示:
原电池是直接把化学能转化为电能的装置.如图所示: