Ő‚ńŅńŕ»›
°ĺŐ‚ńŅ°ŅĶ™‘™ňō“≤”ŽŐľ‘™ňō“Ľ—ýīś‘ŕ“ĽŌĶŃ–«‚ĽĮőÔ,»ÁNH3°ĘN2H4°ĘN3H5°ĘN4H6Ķ»°£«ŽĽōīūŌ¬Ń–”–Ļōő Ő‚£ļ
£®1£©…Ō ŲĶ™ĶńŌĶŃ–«‚ĽĮőÔĶńÕ® Ĺő™____________°£
£®2£©“—÷™£ļ2H2(g)+O2(g)=2H2O(g) °ųH=-483.6kJ°§mol-1,≤ť‘ńőńŌ◊◊ ŃŌ£¨ĽĮ—ßľŁľŁń‹»ÁŌ¬ĪŪ£ļ
ĽĮ—ßľŁ | H-H | N=N | N-H |
E/kJ°§mol-1 | 436 | 946 | 391 |
ĘŔįĪ∑÷Ĺ‚∑ī”¶NH3(g)![]()
![]() N2(g)+
N2(g)+ ![]() H2(g)ĶńĽÓĽĮń‹Ea1=300kJ°§mol-1£¨‘ÚļŌ≥…įĪ∑ī”¶
H2(g)ĶńĽÓĽĮń‹Ea1=300kJ°§mol-1£¨‘ÚļŌ≥…įĪ∑ī”¶![]()
![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g)![]() NH3(g)ĶńĽÓĽĮń‹Ea2=___________°£
NH3(g)ĶńĽÓĽĮń‹Ea2=___________°£
ĘŕįĪ∆ÝÕͻ껾…’…ķ≥…Ķ™∆ÝļÕ∆ÝŐ¨ňģĶń»»ĽĮ—ß∑Ĺ≥Ő Ĺő™__________________________°£
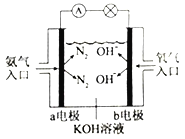
ĘŘ»Á”“Õľ «įĪ∆Ý»ľŃŌĶÁ≥ō ĺ“‚Õľ°£aĶÁľęĶńĶÁľę∑ī”¶ Ĺő™________________°£
£®3£©“—÷™NH3°§H2Oő™“Ľ‘™»űľÓ°£N2H4°§H2Oő™∂Ģ‘™»űľÓ£¨‘ŕňģ»‹“ļ÷–Ķń“Ľľ∂ĶÁņŽ∑Ĺ≥Ő ĹĪŪ ĺő™£ļN2H4°§H2O+H2O![]() N2H5°§H2O++OH-°£‘ÚŅ…»‹–‘—ő—őňŠŽ¬(N2H6Cl2)Ķŕ“Ľ≤ĹňģĹ‚ĶńņŽ◊”∑Ĺ≥Ő Ĺő™__________________;»‹“ļ÷–ņŽ◊”Ň®∂»”…īůĶĹ–°ĶńŇŇŃ–ň≥–Úő™___________________°£
N2H5°§H2O++OH-°£‘ÚŅ…»‹–‘—ő—őňŠŽ¬(N2H6Cl2)Ķŕ“Ľ≤ĹňģĹ‚ĶńņŽ◊”∑Ĺ≥Ő Ĺő™__________________;»‹“ļ÷–ņŽ◊”Ň®∂»”…īůĶĹ–°ĶńŇŇŃ–ň≥–Úő™___________________°£
£®4£©Õ®Ļżľ∆ň„Ň–∂®(NH4)2SO3»‹“ļĶńňŠľÓ–‘(–ī≥Ųľ∆ň„Ļż≥Ő)________________________°£(“—÷™£ļįĪňģKb=1.8°Ń10-5;H2SO3 Ka1=1.3°Ń10-2Ka2=6.3°Ń10-8)°£
°ĺīūįł°Ņ NnH(n+2) 254kJ°§mol-1 4NH3(g)+3O2(g)=2N2(g)+6H2O(g)°ųH=-1266.8kJ°§mol-1 NH3+6OH--6e-=N2°Ł+6H2O N2H62++H2O![]() N2H5°§H2O++H+ [Cl-]>[N2H62+]>[H+]>[N2H5°§H2O+]>[OH-] O32-ĶńňģĹ‚≥£ żKh1=
N2H5°§H2O++H+ [Cl-]>[N2H62+]>[H+]>[N2H5°§H2O+]>[OH-] O32-ĶńňģĹ‚≥£ żKh1=![]() =
=![]() =
=![]() °Ń10-7£¨NH4+ĶńňģĹ‚≥£ żKh=
°Ń10-7£¨NH4+ĶńňģĹ‚≥£ żKh=![]() =
=![]() =
=![]() °Ń10-10£¨Kh1>Kh£¨Ļ SO32-ňģĹ‚∆ū÷ų“™◊ų”√∂Ý≥ ľÓ–‘
°Ń10-10£¨Kh1>Kh£¨Ļ SO32-ňģĹ‚∆ū÷ų“™◊ų”√∂Ý≥ ľÓ–‘
°ĺĹ‚őŲ°Ņ£®1£©Õ®ĻżĻŘ≤žŅ…÷™£ļĶ™”Ž«‚‘≠◊” żŌŗ≤Ó2łŲ£¨Õ® Ĺő™NnH(n+2)£¨’ż»∑īūįł£ļNnH(n+2)£Ľ
£®2£©ĘŔNH3(g)![]()
![]() N2(g)+
N2(g)+ ![]() H2(g)£¨°ųH=∑ī”¶őÔĶń◊‹ľŁń‹-…ķ≥…őÔĶń◊‹ľŁń‹=3°Ń391-1/2°Ń946-3/2°Ń436=+46 kJ°§mol-1; °ųH= Ea1- Ea2=46£Ľ300- Ea2=46£¨Ea2=254kJ°§mol-1£Ľ
H2(g)£¨°ųH=∑ī”¶őÔĶń◊‹ľŁń‹-…ķ≥…őÔĶń◊‹ľŁń‹=3°Ń391-1/2°Ń946-3/2°Ń436=+46 kJ°§mol-1; °ųH= Ea1- Ea2=46£Ľ300- Ea2=46£¨Ea2=254kJ°§mol-1£Ľ
Ęŕ 2H2(g)+O2(g)=2H2O(g) °ųH=-483.6kJ°§mol-1, NH3(g)![]()
![]() N2(g)+
N2(g)+ ![]() H2(g)£¨°ųH==+46 kJ°§mol-1;
H2(g)£¨°ųH==+46 kJ°§mol-1;
łý図«ňĻ∂®¬…£ļŃĹłŲ Ĺ◊”’ŻņŪÕÍ≥…ļů£¨4NH3(g)+3O2(g)=2N2(g)+6H2O(g) °ųH=1266.8kJ°§mol-1£Ľ’ż»∑īūįł£ļ4NH3(g)+3O2(g)=2N2(g)+6H2O(g) °ųH=1266.8kJ°§mol-1£Ľ
ĘŘ įĪ∆Ý»ľŃŌĶÁ≥ō£¨įĪ∆Ý◊Ųłļľę£¨łļľę∑Ę…ķ—űĽĮ∑ī”¶£¨ ß»•ĶÁ◊”£¨‘ŕľÓ–‘Ľ∑ĺ≥Ō¬—űĽĮő™Ķ™∆Ý£Ľľę∑ī”¶ő™NH3+6OH--6e-=N2°Ł+6H2O£Ľ’ż»∑īūįłő™£ļNH3+6OH--6e-=N2°Ł+6H2O£Ľ
£®3£©N2H4H2Oő™∂Ģ‘™»űľÓ£¨N2H6Cl2ő™«ŅňŠ»űľÓ—ő£¨ňģĹ‚Ō‘ňŠ–‘£¨Ķŕ“Ľ≤ĹňģĹ‚ĶńņŽ◊”∑Ĺ≥Ő Ĺő™N2H62++H2O![]() N2H5°§H2O++H+£Ľ»‹“ļ÷–ĶńņŽ◊”£ļCl-°ĘN2H62+°ĘH+°ĘOH-°ĘN2H5°§H2O+
N2H5°§H2O++H+£Ľ»‹“ļ÷–ĶńņŽ◊”£ļCl-°ĘN2H62+°ĘH+°ĘOH-°ĘN2H5°§H2O+
£Ľłýĺ›ňģĹ‚Ļś¬…£ļ»‹“ļ÷–ņŽ◊”Ň®∂»īů–°ŇŇŃ–ň≥–Úő™£ļc(Cl-)>c(N2H62+)>c(H+)>c(N2H5°§H2O+)
>c(OH-)£Ľ’ż»∑īūįł£ļc(Cl-)>c(N2H62+)> c(H+)>c(N2H5°§H2O+)>c(OH-)£Ľ
£®4£©—őņŗňģĹ‚∆Ĺļ‚≥£ żKh=KW/Ka £¨∆š÷–KWő™ņŽ◊”Ľż£¨Kaő™»űňŠĽÚ»űľÓĶńĶÁņŽ∆Ĺļ‚≥£ ż£Ľ
“—÷™£ļįĪňģKb=1.8°Ń10-5;H2SO3 Ka1=1.3°Ń10-2 Ka2=6.3°Ń10-8)£ĽNH4+ĶńňģĹ‚≥£ żKh1=![]() =
=![]() =
=![]() °Ń10-10£ĽSO32-ĶńňģĹ‚≥£ żKh2=
°Ń10-10£ĽSO32-ĶńňģĹ‚≥£ żKh2=![]() =
=![]() =
=![]() °Ń10-7£¨Kh1<Kh£¨∆Ĺļ‚≥£ ż‘Ĺīů£¨ňģĹ‚ń‹Ń¶ĺÕ‘Ĺ«Ņ£¨Ļ SO32-ňģĹ‚∆ū÷ų“™◊ų”√∂Ý≥ ľÓ–‘£Ľ’ż»∑īūįł£ļľÓ–‘£Ľ“—÷™£ļįĪňģKb=1.8°Ń10-5;H2SO3 Ka1=1.3°Ń10-2 Ka2=6.3°Ń10-8)£ĽNH4+ĶńňģĹ‚≥£ żKh1=
°Ń10-7£¨Kh1<Kh£¨∆Ĺļ‚≥£ ż‘Ĺīů£¨ňģĹ‚ń‹Ń¶ĺÕ‘Ĺ«Ņ£¨Ļ SO32-ňģĹ‚∆ū÷ų“™◊ų”√∂Ý≥ ľÓ–‘£Ľ’ż»∑īūįł£ļľÓ–‘£Ľ“—÷™£ļįĪňģKb=1.8°Ń10-5;H2SO3 Ka1=1.3°Ń10-2 Ka2=6.3°Ń10-8)£ĽNH4+ĶńňģĹ‚≥£ żKh1=![]() =
=![]() =
=![]() °Ń10-10£ĽSO32-ĶńňģĹ‚≥£ żKh2=
°Ń10-10£ĽSO32-ĶńňģĹ‚≥£ żKh2=![]() =
=![]() =
=![]() °Ń10-7£¨Kh1<Kh£¨∆Ĺļ‚≥£ ż‘Ĺīů£¨ňģĹ‚ń‹Ń¶ĺÕ‘Ĺ«Ņ£¨Ļ SO32-ňģĹ‚∆ū÷ų“™◊ų”√∂Ý≥ ľÓ–‘£Ľ
°Ń10-7£¨Kh1<Kh£¨∆Ĺļ‚≥£ ż‘Ĺīů£¨ňģĹ‚ń‹Ń¶ĺÕ‘Ĺ«Ņ£¨Ļ SO32-ňģĹ‚∆ū÷ų“™◊ų”√∂Ý≥ ľÓ–‘£Ľ

°ĺŐ‚ńŅ°ŅļŌ≥…įĪľľ űĶńīīŃĘŅ™ĪŔŃň»ňĻ§ĻŐĶ™Ķń÷ō“™Õĺĺ∂£¨∆š—–ĺŅņī◊‘’ż»∑ĶńņŪ¬Ř÷łĶľ£¨ļŌ≥…įĪ∑ī”¶Ķń∆Ĺļ‚≥£ żK÷ĶļÕő¬∂»ĶńĻōŌĶ»ÁĪŪ£ļ
ő¬ ∂»£®°ś£© | 360 | 440 | 520 |
K÷Ķ | 0.036 | 0.010 | 0.0038 |
£®1£©ĘŔ”……ŌĪŪ żĺ›Ņ…÷™ł√∑ī”¶Ķń¶§H_____ 0£®ŐÓŐÓ°į£ĺ°Ī°Ę°į=°ĪĽÚ°į£ľ°Ī£©°£
ĘŕŌ¬Ń–īŽ ©ń‹”√ņ’ŌńŐōŃ–‘≠ņŪĹ‚ Õ «_____£®ŐÓ–ÚļŇ£©°£
a£ģ‘Ųīů—Ļ«Ņ”–ņŻ”ŕļŌ≥…įĪ b£ģ Ļ”√ļŌ ĶńīŖĽĮľŃ”–ņŻ”ŕŅžňŔ…ķ≥…įĪ
c£ģ…ķ≤ķ÷––Ť“™…żłŖő¬∂»÷Ń500°„C◊ů”“ d£ģ–Ť“™ Ļ”√ĻżŃŅĶńN2£¨ŐŠłŖH2◊™ĽĮ¬
£®2£©0.2mol NH3»‹”ŕňģļů‘Ŕ”Žļ¨”–0.2mol H2SO4ĶńŌ°»‹“ļÕÍ»ę∑ī”¶∑Ň»»Q kJ£¨«Žń„”√»»ĽĮ—ß∑Ĺ≥Ő ĹĪŪ ĺ∆š∑ī”¶ Ĺ£ļ___________________________________°£
£®3£©≥£ő¬ Ī£¨Ĺęa molįĪ∆Ý»‹”ŕňģļů£¨‘ŔÕ®»Žb mol¬»ĽĮ«‚£¨»‹“ļŐŚĽżő™1L£¨«“c£®NH4+£©=c£®Cl©Ā£©£¨‘Ú“ĽňģļŌįĪĶńĶÁņŽ∆Ĺļ‚≥£ żKb=_____£®”√abĪŪ ĺ£©°£
£®4£©‘≠ŃŌ∆ÝH2Ņ…Õ®Ļż∑ī”¶ CH4£®g£©+H2O £®g£©![]() CO£®g£©+3H2£®g£© ĽŮ»°£¨“—÷™ł√∑ī”¶÷–£¨ĶĪ≥ű ľĽžļŌ∆Ý÷–Ķń
CO£®g£©+3H2£®g£© ĽŮ»°£¨“—÷™ł√∑ī”¶÷–£¨ĶĪ≥ű ľĽžļŌ∆Ý÷–Ķń![]() ļ„∂® Ī£¨ő¬∂»°Ę—Ļ«Ņ∂‘∆Ĺļ‚ĽžļŌ∆ÝCH4ļ¨ŃŅĶń”įŌž»ÁÕľňý ĺ£ļ
ļ„∂® Ī£¨ő¬∂»°Ę—Ļ«Ņ∂‘∆Ĺļ‚ĽžļŌ∆ÝCH4ļ¨ŃŅĶń”įŌž»ÁÕľňý ĺ£ļ
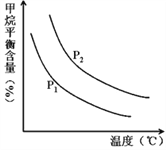
ĘŔÕľ÷–£¨ŃĹŐű«ķŌŖĪŪ ĺ—Ļ«ŅĶńĻōŌĶ «£ļP1_____P2£®ŐÓ°į£ĺ°Ī°Ę°į=°ĪĽÚ°į£ľ°Ī£©°£
Ęŕ∆šňŁŐűľĢ“Ľ∂®£¨…żłŖő¬∂»£¨«‚∆ÝĶń≤ķ¬ ĽŠ______£®ŐÓ°į‘Ųīů°Ī£¨°įľű–°°Īľű–°£¨°į≤ĽĪš°Ī≤ĽĪš£©°£
£®5£©‘≠ŃŌ∆ÝH2ĽĻŅ…Õ®Ļż∑ī”¶CO£®g£©+H2O£®g£©![]() CO2£®g£©+H2£®g£©ĽŮ»°°£
CO2£®g£©+H2£®g£©ĽŮ»°°£
ĘŔT°ś Ī£¨ŌÚ»›ĽżĻŐ∂®ő™5 LĶń»›∆ų÷–≥š»Ž1mol H2O£®g£©ļÕ1mol CO£¨ ∑ī”¶īÔ∆Ĺļ‚ļů£¨≤‚Ķ√COĶńŇ®∂»0.08 mol/L£¨ł√ő¬∂»Ō¬∑ī”¶Ķń∆Ĺļ‚≥£ żK÷Ķő™_____°£
ĘŕĪ£≥÷ő¬∂»»‘ő™T°ś£¨»›ĽżŐŚĽżő™5L£¨łńĪšňģ’Ű∆ÝļÕCOĶń≥ű ľőÔ÷ ĶńŃŅ÷ģĪ»£¨≥š»Ž»›∆ųĹÝ––∑ī”¶£¨Ō¬Ń–√Ť Ųń‹ĻĽňĶ√ųŐŚŌĶī¶”ŕ∆Ĺļ‚◊īŐ¨Ķń «_____£®ŐÓ–ÚļŇ£©°£
a£ģ»›∆ųńŕ—Ļ«Ņ≤Ľňś ĪľšłńĪš
b£ģĽžļŌ∆ÝŐŚĶń√‹∂»≤Ľňś ĪľšłńĪš
c£ģĶ•őĽ Īľšńŕ…ķ≥…a mol CO2ĶńÕ¨ ĪŌŻļńa mol H2
d£ģĽžļŌ∆Ý÷–n£®CO£©£ļn£®H2O£©£ļn£®CO2£©£ļn£®H2£©=1£ļ16£ļ6£ļ6
°ĺŐ‚ńŅ°ŅľÓ ĹŐľňŠÕ≠ļÕ¬»∆Ý∂ľ «”√ÕĺĻ„∑ļĶńĽĮĻ§‘≠ŃŌ°£
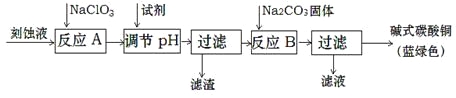
£®1£©Ļ§“Ķ…ŌŅ…”√ňŠ–‘ŅŐ ī∑Ō“ļ£®÷ų“™≥…∑÷”–Cu2+°ĘFe2+°ĘFe3+°ĘH+°ĘCl£©÷∆ĪłľÓ ĹŐľňŠÕ≠£¨∆š÷∆ĪłĻż≥Ő»ÁŌ¬£ļ
“—÷™£ļCu2+°ĘFe2+°ĘFe3+…ķ≥…≥ŃĶŪĶńpH»ÁŌ¬£ļ
őÔ÷ | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
Ņ™ ľ≥ŃĶŪpH | 4.2 | 5.8 | 1.2 |
ÕÍ»ę≥ŃĶŪpH | 6.7 | 8.3 | 3.2 |
ĘŔ¬»ňŠń∆Ķń◊ų”√ « £Ľ
Ęŕ∑ī”¶AļůĶųĹ໋“ļĶńpH∑∂őß”¶ő™ °£
ĘŘĶŕ“ĽīőĻż¬ňĶ√ĶĹĶń≤ķ∆∑ŌīĶ” Ī£¨»ÁļőŇ–∂Ō“—ĺ≠ŌīĺĽ£Ņ °£
Ę‹‘ž≥…ņ∂¬Ő…ę≤ķ∆∑÷–Ľž”–CuO‘”÷ Ķń‘≠“Ú « °£
£®2£©ń≥—ßŌį–°◊ť‘ŕ Ķ—ť “÷–ņŻ”√Ō¬Õľňý ĺ◊į÷√÷∆»°¬»∆Ý≤ĘŐĹĺŅ∆š–‘÷ °£

ĘŔ Ķ—ť “”√∂Ģ—űĽĮ√ŐļÕŇ®—őňŠľ”»»÷∆»°¬»∆Ý£¨ňý”√“«∆ų–Ť“™ľž¬©Ķń”– °£
Ęŕ»ŰC÷–∆∑ļž»‹“ļÕ …ę£¨ń‹∑Ů÷§√ų¬»∆Ý”Žňģ∑ī”¶Ķń≤ķőÔ”–∆Įį◊–‘£¨ňĶ√ų‘≠“Ú °£īň ĪB◊į÷√÷–∑Ę…ķ∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺ «___________ _____°£
ĘŘ–ī≥ŲA»‹“ļ÷–ĺŖ”–«Ņ—űĽĮ–‘őĘŃ£ĶńĽĮ—ß Ĺ °£»ŰŌÚA»‹“ļ÷–ľ”»ŽNaHCO3∑Řń©£¨ĽŠĻŘ≤žĶĹĶńŌ÷Ōů « °£

