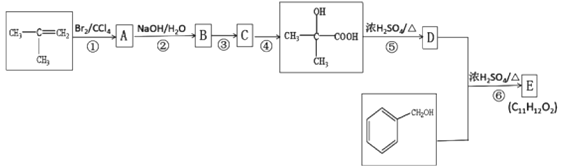
��Ŀ����
����Ŀ���ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ�����
�� �ȣ����� | 360 | 440 | 520 |
Kֵ | 0.036 | 0.010 | 0.0038 |
��1�������ϱ����ݿ�֪�÷�Ӧ����H_____ 0����������������=��������������
�����д�ʩ������������ԭ��������_____������ţ���
a������ѹǿ�����ںϳɰ� b��ʹ�ú��ʵĴ��������ڿ������ɰ�
c����������Ҫ�����¶���500��C���� d����Ҫʹ�ù�����N2�����H2ת����
��2��0.2mol NH3����ˮ�����뺬��0.2mol H2SO4��ϡ��Һ��ȫ��Ӧ����Q kJ���������Ȼ�ѧ����ʽ��ʾ�䷴Ӧʽ��___________________________________��
��3������ʱ����a mol��������ˮ����ͨ��b mol�Ȼ��⣬��Һ���Ϊ1L����c��NH4+��=c��Cl��������һˮ�ϰ��ĵ���ƽ�ⳣ��Kb=_____����ab��ʾ����
��4��ԭ����H2��ͨ����Ӧ CH4��g��+H2O ��g��![]() CO��g��+3H2��g�� ��ȡ����֪�÷�Ӧ�У�����ʼ������е�
CO��g��+3H2��g�� ��ȡ����֪�÷�Ӧ�У�����ʼ������е�![]() �㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ����ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ����ͼ��ʾ��
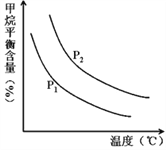
��ͼ�У��������߱�ʾѹǿ�Ĺ�ϵ�ǣ�P1_____P2��������������=��������������
����������һ���������¶ȣ������IJ��ʻ�______������������������С����С�������������䣩��
��5��ԭ����H2����ͨ����ӦCO��g��+H2O��g��![]() CO2��g��+H2��g����ȡ��
CO2��g��+H2��g����ȡ��
��T��ʱ�����ݻ��̶�Ϊ5 L�������г���1mol H2O��g����1mol CO�� ��Ӧ��ƽ����CO��Ũ��0.08 mol/L�����¶��·�Ӧ��ƽ�ⳣ��KֵΪ_____��
�ڱ����¶���ΪT�����ݻ����Ϊ5L���ı�ˮ������CO�ij�ʼ���ʵ���֮�ȣ������������з�Ӧ�����������ܹ�˵����ϵ����ƽ��״̬����_____������ţ���
a��������ѹǿ����ʱ��ı�
b�����������ܶȲ���ʱ��ı�
c����λʱ��������a mol CO2��ͬʱ����a mol H2
d���������n��CO����n��H2O����n��CO2����n��H2��=1��16��6��6
���𰸡� < ad NH3��H2O��aq��+H2SO4��aq���T�TNH4HSO4��aq��+H2O��l����H=��5Q kJmol��1 ![]() �� ���� 2.25 cd
�� ���� 2.25 cd
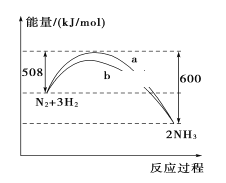
����������1���ٹ۲��������¶ȵ�����K��С����֪�÷�ӦΪ���ȷ�Ӧ����H�� 0��������ƽ��ʱH2��ת���ʣ��ı�����ʹƽ�������ƶ������Լ�ѹ�����£�����N2��Ũ�ȣ���С������Ũ�ȣ�����������ʹƽ���ƶ������Դ�ѡa��d����2��0.2mol NH3����ˮ��õ�0.2mol NH3��H2O�����뺬��0.2mol H2SO4��ϡ��Һ��ȫ��Ӧ����0.2mol NH4HSO4��ˮ������Q kJ��������1mol NH4HSO4ʱ�ų�������Ϊ��5Q kJ�����Ȼ�ѧ����ʽ��ʾ�䷴ӦʽΪ��NH3��H2O��aq��+H2SO4��aq���T�TNH4HSO4��aq��+H2O��l����H=��5Q kJmol��1����3����a molL-1�İ�ˮ��b molL-1������������ϣ���Ӧ����Һ�����ԣ���Һ��c��OH-��=1��10-7mol/L����Һ��c��NH4+��=c��Cl-��=![]() mol/L����Ϻ�Ӧǰc��NH3H2O��=
mol/L����Ϻ�Ӧǰc��NH3H2O��=![]() mol/L����Ӧ��c��NH3H2O��=��
mol/L����Ӧ��c��NH3H2O��=��![]() -
-![]() ��mol/L��Kb=
��mol/L��Kb=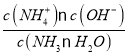 =
= =10-7
=10-7![]() ����4��������ͼ��仯��������ͬ�¶��£�CH4��g��+H2O ��g���TCO��g��+3H2��g������Ӧ�������������ķ�Ӧ��ѹǿԽ��ƽ�������ƶ�������ƽ�⺬��Խ�ߣ�����P1��P2����ѹǿһ�����¶����ߣ�����ƽ�⺬����С��ƽ�������ƶ��������IJ��ʻ�������
����4��������ͼ��仯��������ͬ�¶��£�CH4��g��+H2O ��g���TCO��g��+3H2��g������Ӧ�������������ķ�Ӧ��ѹǿԽ��ƽ�������ƶ�������ƽ�⺬��Խ�ߣ�����P1��P2����ѹǿһ�����¶����ߣ�����ƽ�⺬����С��ƽ�������ƶ��������IJ��ʻ�������
��5���ٸ��ݻ�ѧƽ������ʽ����ƽ��Ũ�ȣ�T��ʱ�����ݻ��̶�Ϊ5 L�������г���1mol H2O��g����1mol CO�� ��Ӧ��ƽ����CO��Ũ��0.08 mol/L��
CO��g��+H2O��g��![]() CO2��g��+H2��g��
CO2��g��+H2��g��
��ʼŨ��(mol/L) 0.2 0.2 0 0
�ı�Ũ��(mol/L) 0.12 0.12 0.12 0.12
ƽ��Ũ��(mol/L) 0.08 0.08 0.12 0.12
����¶��·�Ӧ��ƽ�ⳣ��K=![]() =2.25��
=2.25��
�ڻ�ѧƽ��״̬����Ӧ�����淴Ӧ������ͬ�����ɷֺ������ֲ������ѡ���ӦCO��g��+H2O��g��![]() CO2��g��+H2��g����������������Ӧ����a����Ӧ�����к�ƽ��״̬��ѹǿ��ͬ��������ѹǿ����ʱ��ı䣬����˵����Ӧ�ﵽƽ��״̬��ѡ��a�����ϣ�b���������������غ㣬��Ӧǰ������������䣬��Ӧ�����к�ƽ��״̬�£����������ܶȲ���ʱ��ı䣬����˵����Ӧ�ﵽƽ��״̬��ѡ��b�����ϣ�c����λʱ��������a mol CO2��ͬʱ����a mol H2 ��˵��������̼�����������淴Ӧ������ͬ��˵����Ӧ�ﵽƽ��״̬��ѡ��c���ϣ�d���������n��CO����n��H2O����n��CO2����n��H2��=1��16��6��6�����ݷ�Ӧǰ���������ʵ�����ͬ�������������ʵ�������Ũ�ȼ���Ũ���̺�ƽ�ⳣ���Ƚϣ�Q=
CO2��g��+H2��g����������������Ӧ����a����Ӧ�����к�ƽ��״̬��ѹǿ��ͬ��������ѹǿ����ʱ��ı䣬����˵����Ӧ�ﵽƽ��״̬��ѡ��a�����ϣ�b���������������غ㣬��Ӧǰ������������䣬��Ӧ�����к�ƽ��״̬�£����������ܶȲ���ʱ��ı䣬����˵����Ӧ�ﵽƽ��״̬��ѡ��b�����ϣ�c����λʱ��������a mol CO2��ͬʱ����a mol H2 ��˵��������̼�����������淴Ӧ������ͬ��˵����Ӧ�ﵽƽ��״̬��ѡ��c���ϣ�d���������n��CO����n��H2O����n��CO2����n��H2��=1��16��6��6�����ݷ�Ӧǰ���������ʵ�����ͬ�������������ʵ�������Ũ�ȼ���Ũ���̺�ƽ�ⳣ���Ƚϣ�Q=![]() =2.25=K��˵����Ӧ�ﵽƽ��״̬��ѡ��d���ϡ���ѡcd��
=2.25=K��˵����Ӧ�ﵽƽ��״̬��ѡ��d���ϡ���ѡcd��

 �ݾ�ѵ������ϵ�д�
�ݾ�ѵ������ϵ�д� С����ȫ�ܼ��ϵ�д�
С����ȫ�ܼ��ϵ�д�����Ŀ����Ԫ��Ҳ��̼Ԫ��һ������һϵ���⻯��,��NH3��N2H4��N3H5��N4H6�ȡ���ش������й����⣺
��1����������ϵ���⻯���ͨʽΪ____________��
��2����֪��2H2(g)+O2(g)=2H2O(g) ��H=-483.6kJ��mol-1,�����������ϣ���ѧ���������±���
��ѧ�� | H-H | N=N | N-H |
E/kJ��mol-1 | 436 | 946 | 391 |
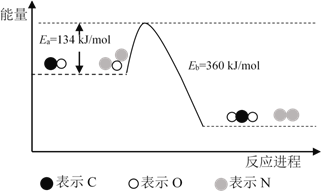
�����ֽⷴӦNH3(g)![]()
![]() N2(g)+
N2(g)+ ![]() H2(g)�Ļ��Ea1=300kJ��mol-1����ϳɰ���Ӧ
H2(g)�Ļ��Ea1=300kJ��mol-1����ϳɰ���Ӧ![]()
![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g)![]() NH3(g)�Ļ��Ea2=___________��
NH3(g)�Ļ��Ea2=___________��
��������ȫȼ�����ɵ�������̬ˮ���Ȼ�ѧ����ʽΪ__________________________��
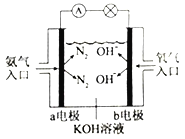
������ͼ�ǰ���ȼ�ϵ��ʾ��ͼ��a�缫�ĵ缫��ӦʽΪ________________��
��3����֪NH3��H2OΪһԪ���N2H4��H2OΪ��Ԫ�����ˮ��Һ�е�һ�����뷽��ʽ��ʾΪ��N2H4��H2O+H2O![]() N2H5��H2O++OH-�����������������(N2H6Cl2)��һ��ˮ������ӷ���ʽΪ__________________;��Һ������Ũ���ɴ�С������˳��Ϊ___________________��
N2H5��H2O++OH-�����������������(N2H6Cl2)��һ��ˮ������ӷ���ʽΪ__________________;��Һ������Ũ���ɴ�С������˳��Ϊ___________________��
��4��ͨ�������ж�(NH4)2SO3��Һ�������(д���������)________________________��(��֪����ˮKb=1.8��10-5;H2SO3 Ka1=1.3��10-2Ka2=6.3��10-8)��