题目内容
【题目】A、B、C、D、E为短周期元素,原子序数依次增大,质子数之和为40,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素,问:
(1)B元素在周期表中的位置为_________________;
(2)D的单质投入A2C中得到一种无色溶液。E的单质在该无色溶液中反应的离子方程式为_____________________。
(3)用电子式表示由A、C两元素组成的四核18电子的共价化合物的形成过程_____________。
(4)以往回收电路板中铜的方法是灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡既达到了上述目的,又保护了环境,该反应的化学方程式为___________________。
(5)乙醇(C2H5OH)燃料电池(Pt为电极),以KOH为电解质溶液,写出负极电极反应式__________,当转移电子1.2mol时,消耗氧气标况下体积为______________。
【答案】 第二周期第VA族 2Al+2H2O+2OH-=2AlO2-+3H2↑ ![]() H2O2+H2SO4+Cu=CuSO4+2H2O C2H5OH - 12e- +16OH- =2CO32- + 11H2O 6.72L
H2O2+H2SO4+Cu=CuSO4+2H2O C2H5OH - 12e- +16OH- =2CO32- + 11H2O 6.72L
【解析】A、B、C、D、E为短周期元素,A到E原子序数依次增大,E是地壳中含量最多的金属元素,则E为Al;A、C能形成两种液态化合物A2C和A2C2,则A为H,C为O;A、D同主族,由A、D的原子序数相差大于2,所以D为Na;元素的质子数之和为40,则B的原子序数为40-1-8-11-13=7,所以B为N,据此进行解答。
根据上述分析,A为H,B为N,C为O,D为Na,E为Al。
(1)B为N,原子序数为7,位于元素周期表中第二周期ⅤA族,故答案为:第二周期ⅤA族;
(2)Na与水反应生成NaOH,Al与NaOH溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;
(3)由A、C两元素组成的四核18电子的共价化合物为过氧化氢,用电子式表示过氧化氢的的形成过程为![]() ,故答案为:
,故答案为:![]() ;
;
(4)A2C2为H2O2,与Cu、硫酸发生氧化还原反应生成硫酸铜和水,该反应方程式为:H2O2+H2SO4+Cu=CuSO4+2H2O,故答案为:H2O2+H2SO4+Cu=CuSO4+2H2O;
(5)乙醇(C2H5OH)燃料电池(Pt为电极),以KOH为电解质溶液,乙醇在负极发生氧化反应生成碳酸钾,电极反应式为C2H5OH - 12e- +16OH- =2CO32- + 11H2O,氧气在正极发生还原反应,电极反应式为O2+2H2O+4e- =4OH-,当转移电子1.2mol时,消耗氧气![]() =0.3mol,标况下体积为0.3mol×22.4L/mol=6.72L,故答案为:C2H5OH - 12e- +16OH- =2CO32- + 11H2O;6.72L。
=0.3mol,标况下体积为0.3mol×22.4L/mol=6.72L,故答案为:C2H5OH - 12e- +16OH- =2CO32- + 11H2O;6.72L。

【题目】氮元素也与碳元素一样存在一系列氢化物,如NH3、N2H4、N3H5、N4H6等。请回答下列有关问题:
(1)上述氮的系列氢化物的通式为____________。
(2)已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,查阅文献资料,化学键键能如下表:
化学键 | H-H | N=N | N-H |
E/kJ·mol-1 | 436 | 946 | 391 |
①氨分解反应NH3(g)![]()
![]() N2(g)+
N2(g)+ ![]() H2(g)的活化能Ea1=300kJ·mol-1,则合成氨反应
H2(g)的活化能Ea1=300kJ·mol-1,则合成氨反应![]()
![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g)![]() NH3(g)的活化能Ea2=___________。
NH3(g)的活化能Ea2=___________。
②氨气完全燃烧生成氮气和气态水的热化学方程式为__________________________。
③如右图是氨气燃料电池示意图。a电极的电极反应式为________________。
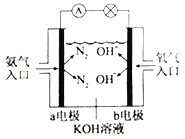
(3)已知NH3·H2O为一元弱碱。N2H4·H2O为二元弱碱,在水溶液中的一级电离方程式表示为:N2H4·H2O+H2O![]() N2H5·H2O++OH-。则可溶性盐盐酸肼(N2H6Cl2)第一步水解的离子方程式为__________________;溶液中离子浓度由大到小的排列顺序为___________________。
N2H5·H2O++OH-。则可溶性盐盐酸肼(N2H6Cl2)第一步水解的离子方程式为__________________;溶液中离子浓度由大到小的排列顺序为___________________。
(4)通过计算判定(NH4)2SO3溶液的酸碱性(写出计算过程)________________________。(已知:氨水Kb=1.8×10-5;H2SO3 Ka1=1.3×10-2Ka2=6.3×10-8)。
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)⑧的原子结构示意图为_________。
(2)②的气态氢化物分子的结构式为_____________。
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是________________。(填化学式)
(4)⑤、⑥元素的金属性强弱依次为___________。(填“增大”、“减小”或“不变”)
(5)④、⑤、⑥的形成的简单离子半径依次_______。(填“增大”、“减小”或“不变”)
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式:_______。
【题目】下表是周期表中的一部分,根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | J | F | H | I |
(1)表中元素,化学性质最不活泼的元素是__________。
(2)最高价氧化物的水化物碱性最强的元素是__________。
(3)可用于制半导体材料的元素是_______。
(4)表中元素,只有负价没有正价的元素是_________。