题目内容
4.现有部分短周期元素的原子结构如下表:| 元素 编号 | 元素原子结构 |
| X | 原子结构示意图为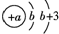 |
| Y | 最外层电子数是次外层电子数的2倍 |
| Z | 原子核内含有12个中子,且其离子的结构示意图为 |
(2)元素Y的最高价氧化物的结构式为O=C=O,Z元素的单质在空气中燃烧产物的电子式
 ,用电子式表示X的气态氢化物的形成过程
,用电子式表示X的气态氢化物的形成过程 .
.(3)Y的最高价氧化物和Z元素的单质在空气中燃烧产物发生反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2;若反应过程中,转移电子数为6.02×1023,则消耗Y的最高价氧化物的质量为1mol.
分析 X原子结构示意图为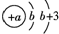 ,应用K层最多容纳2个电子,且L层填充电子,故b=2,则X为N元素;Y元素原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故Y为C元素;Z原子核内含有12个中子,且其离子的结构示意图为
,应用K层最多容纳2个电子,且L层填充电子,故b=2,则X为N元素;Y元素原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故Y为C元素;Z原子核内含有12个中子,且其离子的结构示意图为 ,则Z元素原子质子数为11,故Z为Na,据此解答.
,则Z元素原子质子数为11,故Z为Na,据此解答.
解答 解:X原子结构示意图为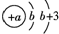 ,应用K层最多容纳2个电子,且L层填充电子,故b=2,则X为N元素;Y元素原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故Y为C元素;Z原子核内含有12个中子,且其离子的结构示意图为
,应用K层最多容纳2个电子,且L层填充电子,故b=2,则X为N元素;Y元素原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故Y为C元素;Z原子核内含有12个中子,且其离子的结构示意图为 ,则Z元素原子质子数为11,故Z为Na,
,则Z元素原子质子数为11,故Z为Na,
(1)由上述分析可知,X为N元素;Z元素质子数为11、质子数为12,故其质量数为11+12=23,
故答案为:N;23;
(2)元素Y为碳元素,最高价为+4,最高价氧化物为CO2,结构式为O=C=O,Z元素的单质在空气中燃烧产物为Na2O2,其电子式为 ,X的气态氢化物为NH3,用电子式表示氨气的形成过程为
,X的气态氢化物为NH3,用电子式表示氨气的形成过程为 ,
,
故答案为:O=C=O; ;
; ;
;
(3)Y的最高价氧化物为CO2,Z元素的单质在空气中燃烧产物为Na2O2,二者发生反应的化学方程式为:2CO2+2Na2O2=2Na2CO3+O2,反应过氧化钠中氧元素由-1价升高为0价、由-1价降低为-2价,若反应过程中,转移电子数为6.02×1023,转移电子为1mol,其生成O2为$\frac{1mol}{2}$=0.5mol,故消耗过氧化钠为0.5mol×2=1mol,
故答案为:2CO2+2Na2O2=2Na2CO3+O2;1mol.
点评 本题考查结构性质位置关系应用,难度不大,注意理解掌握用电子式表示化学键或物质的形成过程.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
14.室温时,将盛有NH4HCO3烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸溶液,反应剧烈,大烧杯中的醋酸逐渐凝固(乙酸的熔点:16.6℃),下列说法正确的是( )
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为化学能 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H>0 |
15.一密闭容器中盛有甲烷,在隔绝空气条件下长时间加热到1000℃左右,然后恢复至室温(20℃).这时容器内气体的压强是原来甲烷压强的m倍,原来甲烷的密度是容器内气体密度的n倍.下列判断正确的是( )
| A. | m=2,n=4 | B. | m=0.5,n=4 | C. | m=2,n=0.25 | D. | m=0.5,n=0.25 |
12.常温下,某溶液中由水电离产生的c(H+)=1×10-10mol/L,该溶液的溶质不可能是( )
| A. | KOH | B. | H2SO4 | C. | HClO4 | D. | MgSO4 |
19.下列过程中化学键未被破坏的是( )
| A. | 碘升华 | B. | 溴与H2生成HBr | C. | SO2气体溶于水 | D. | NaCl固体溶于水 |
9.只用一种试剂就能区别NaCl溶液、NaBr溶液、KI溶液、AgNO3溶液,该试剂是( )
| A. | 氯水 | B. | H2O | C. | 稀盐酸 | D. | NaOH溶液 |
16.医学上在对抗癌物质的研究中发现 具有抗癌作用,而
具有抗癌作用,而 没有抗癌作用,对此下列有关叙述正确的是( )
没有抗癌作用,对此下列有关叙述正确的是( )
 具有抗癌作用,而
具有抗癌作用,而 没有抗癌作用,对此下列有关叙述正确的是( )
没有抗癌作用,对此下列有关叙述正确的是( )| A. | 两者互为同分异构体,都是以Pt原子为中心的四面体结构 | |
| B. | 两者互为同分异构体,都是以Pt原子为中心的平面结构 | |
| C. | 两者为同一物质,都是以Pt原子为中心的四面体结构 | |
| D. | 两者为同一物质,都是以Pt原子为中心的平面结构 |
13.4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性.回答下列问题:
(1)元素x在周期表中的位置是三周期,IIA族;
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是HNO3,碱性最强的是Al(OH)3(填化学式).
(3)气体分子(mn)2的电子式为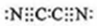 ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.
,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.
| m | n | ||
| x | y |
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是HNO3,碱性最强的是Al(OH)3(填化学式).
(3)气体分子(mn)2的电子式为
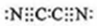 ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.
,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.
14.天然气干法脱硫涉及反应为:H2(g)+CO(g)+SO2(g)?H2O(g)+CO2(g)+S(s)+Q(Q>0).无法提高单位时间脱硫率的措施是( )
| A. | 增加CO的浓度 | B. | 加压 | C. | 分离出硫 | D. | 加催化剂 |