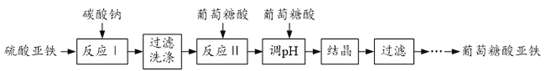
��Ŀ����
����Ŀ��Ħ����[(NH4)2Fe(SO4)2��6H2O]��һ����Ҫ�Ļ���ԭ�ϣ���������ȡ����Fe3O4�Ͳ��������ص���
��1��ȡһ������Ħ������Ʒ�����NaOH��Һ��Ӧ��
�ٸ�������������������õ�Ħ���εĴ���С��ʵ��ֵ����ԭ����______��
��������Fe(OH)2�����м���NaNO2��Һ���Ƶ�����Fe3O4��ͬʱ����NO���÷�Ӧ�����ӷ���ʽΪ______��
��2��Ħ���ξ���������KOH��H2C2O4��Ӧ�ɵõ����������أ�KaFeb(C2O4)c��dH2O�ݣ�����FeԪ�ػ��ϼ�Ϊ+3��
����֪25 �棬H2C2O4�ĵ��볣��Ka1=5.6��10-2��Ka2=5.4��10-5��pH=4��H2C2O4��Һ��c(C2O![]() ):c(HC2O)=______��
):c(HC2O)=______��
��Ϊ��ȷ�����������ص���ɣ�ȷ��ȡ4.910 g��Ʒ�ڵ��������¼��ȣ�������Ʒ��ʣ���������¶ȵı仯��ͼ��ʾ��
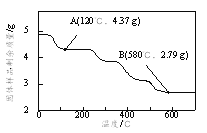
��֪��a��120��ʱ����ȫʧȥ�ᾧˮ��
b��200��~580���ֽ������CO��CO2�ָ�����״�������Ϊ1.008 L��
c��580�����ϲ�������ΪFeO��K2CO3�Ļ���
��������ʵ�����ݼ�������������е�n(Fe3+):n(C2O42-)_____________��д��������̣���
���𰸡� ������������ˮ����Һ���в��ְ���û���ݳ� 3Fe(OH)2+ 2NO��Fe3O4+2NO��+2OH��+2H2O 0.54 ����Ԫ���غ�õ��ֽ����������ΪCO��CO2��n(CO)+n(CO2)=![]() =4.5��10-2 mol��2n(C2O42-)= n(K2CO3)+ n(CO)+n(CO2)= n(K2CO3)+ 4.5��10-2 mol��n(Fe3+)��72 g��mol-1��
=4.5��10-2 mol��2n(C2O42-)= n(K2CO3)+ n(CO)+n(CO2)= n(K2CO3)+ 4.5��10-2 mol��n(Fe3+)��72 g��mol-1��![]() n(K+)��138 g��mol-1=2.79 g�� 3n(Fe3+)+ n(K+)=2��[
n(K+)��138 g��mol-1=2.79 g�� 3n(Fe3+)+ n(K+)=2��[![]() n(K+)+4.5��10-2 mol]��
n(K+)+4.5��10-2 mol]��![]() ����ã�n(Fe3+)=1��10-2 mol n(K+)= 3��10-2 mol��n(C2O42-)=3��10-2 mol��n(Fe3+):n(C2O42-)=1��10-2 mol: 3��10-2 mol=1:3
����ã�n(Fe3+)=1��10-2 mol n(K+)= 3��10-2 mol��n(C2O42-)=3��10-2 mol��n(Fe3+):n(C2O42-)=1��10-2 mol: 3��10-2 mol=1:3
��������(1)��Ħ����[(NH4)2Fe(SO4)2��6H2O]���������Ʒ�Ӧ���ɰ�����������������ˮ����Һ���в��ְ���û���ݳ�����˸�������������������õ�Ħ���εĴ���С��ʵ��ֵ���ʴ�Ϊ��������������ˮ����Һ���в��ְ���û���ݳ���
��Fe(OH)2�����м���NaNO2��Һ���Ƶ�����Fe3O4��ͬʱ����NO����Ӧ�����ӷ���ʽΪ3Fe(OH)2+ 2NO2-��Fe3O4+2NO��+2OH��+2H2O���ʴ�Ϊ��3Fe(OH)2+ 2NO2-��Fe3O4+2NO��+2OH��+2H2O��
(2)����֪25 ����H2C2O4�ĵ��볣��Ka1=5.6��10-2��Ka2=5.4��10-5��pH=4��H2C2O4��Һ��![]() =
=![]() =
=![]() =
=![]() =0.54���ʴ�Ϊ��0.54��
=0.54���ʴ�Ϊ��0.54��
�ڸ���Ԫ���غ�õ��ֽ����������ΪCO��CO2��n(CO)+n(CO2)= ![]() =4.5��10-2 mol��2n(C2O42-)= n(K2CO3)+ n(CO)+n(CO2)= n(K2CO3)+ 4.5��10-2 mol��n(Fe3+)��72 g��mol-1��
=4.5��10-2 mol��2n(C2O42-)= n(K2CO3)+ n(CO)+n(CO2)= n(K2CO3)+ 4.5��10-2 mol��n(Fe3+)��72 g��mol-1��![]() n(K+)��138 g��mol-1=2.79 g�� 3n(Fe3+)+ n(K+)=2��[
n(K+)��138 g��mol-1=2.79 g�� 3n(Fe3+)+ n(K+)=2��[![]() n(K+)+4.5��10-2 mol]��
n(K+)+4.5��10-2 mol]��![]() ����ã�n(Fe3+)=1��10-2 mol��n(K+)= 3��10-2 mol��n(C2O42-)=3��10-2 mol��n(Fe3+):n(C2O42-)=1��10-2 mol: 3��10-2 mol=1:3���ʴ�Ϊ��1:3��
����ã�n(Fe3+)=1��10-2 mol��n(K+)= 3��10-2 mol��n(C2O42-)=3��10-2 mol��n(Fe3+):n(C2O42-)=1��10-2 mol: 3��10-2 mol=1:3���ʴ�Ϊ��1:3��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�