题目内容
1.已知:常温下,HCN的电离常数为Ka=5×10-10.(1)有浓度相同的HCN和NaCN的混合溶液.
①通过计算说明该溶液的酸碱性碱性.
②该溶液中各离子的浓度由大到小的顺序是c(Na+)>c(CN-)>c(OH-)>c(H+).
(2)常温下,向某浓度的HCN溶液中逐滴加入NaOH溶液至溶液呈中性.
①该过程溶液中水的电离程度的变化为增大.
②若混合溶液中c(Na+)=a mol/L,则c(HCN)=200amol/L.
分析 (1)①通过Kh=$\frac{{K}_{W}}{{K}_{a}}$计算,然后比较Ka与Kh的大小来判断;
②溶液显碱性,c(OH-)>c(H+),水解程度大于电离程度,则c(Na+)>c(CN-);
(2)①HCN与NaOH反应生成NaCN,NaCN水解促进水的电离;
②根据Ka=$\frac{c(C{N}^{-})×c({H}^{+})}{c(HCN)}$计算.
解答 解:(1)①已知:常温下,HCN的电离常数为Ka=5×10-10,则Kh=$\frac{{K}_{W}}{{K}_{a}}$=$\frac{1{0}^{-14}}{5×1{0}^{-10}}$=2×10-5,则Ka<Kh,HCN的电离程度小于NaCN的水解程度,溶液显碱性;
故答案为:碱性;
②溶液显碱性,c(OH-)>c(H+),水解程度大于电离程度,则c(Na+)>c(CN-),则该溶液中各离子的浓度由大到小的顺序是:c(Na+)>c(CN-)>c(OH-)>c(H+);
故答案为:c(Na+)>c(CN-)>c(OH-)>c(H+);
(2)①向某浓度的HCN溶液中逐滴加入NaOH溶液至溶液呈中性,HCN与NaOH反应生成NaCN,NaCN水解促进水的电离,所以水的电离程度增大;
故答案为:增大;
②溶液为中性,则由电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CN-),可知c(CN-)=c(Na+)=a mol/L,
Ka=$\frac{c(C{N}^{-})×c({H}^{+})}{c(HCN)}$=$\frac{a×1{0}^{-7}}{c(HCN)}$=5×10-10,则c(HCN)=200amol/L;
故答案为:200a.
点评 本题考查了盐类水解、混合溶液中离子浓度大小判断、Ka和Kh的有关计算等,注意电荷守恒的应用,题目难度中等.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案| A. | 酸性:HCl04>HBr04>HI04 | B. | 碱性:Na0H>Mg(0H)2>Al(0H)3 | ||
| C. | 稳定性;PH3>H2S>HCl | D. | 非金属性:F>0>S |
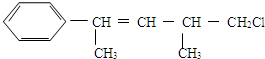
| A. | 不能使酸性KMnO4溶液褪色 | |
| B. | 能使溴水褪色 | |
| C. | 在加热和催化剂作用下,最多能和4 molH2反应 | |
| D. | 一定条件下,能发生取代反应 |
| 实验操作及现象 | 实验结论 | |
| A | 将SO2通入品红溶液中,红色逐渐褪去;再加热已褪色的溶液,溶液又恢复为红色 | 生成的亚硫酸不稳定 |
| B | 向某盐溶液中加入浓NaOH溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝色 | 原溶液中含有NH+4 |
| C | 在某硝酸盐溶液中加入少量稀H2SO4,酸化,再滴加几滴KSCN溶液,溶液变红色 | 原硝酸盐为Fe(NO3)3 |
| D | 将淀粉液和稀硫酸混合微热:一段时间后加入银氨溶液,振荡,水溶加热,试管内壁未出现银镜 | 淀粉一定尚未水解 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 化学键 | B. | 中心原子杂化类型 | ||
| C. | 分子构型 | D. | 分子间作用力 |
| A. | 72 | B. | 53 | C. | 19 | D. | 125 |
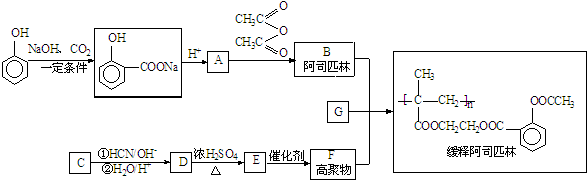
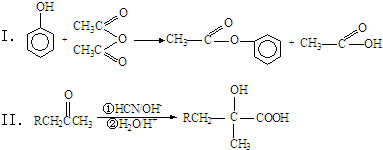
 ,写出E→F的反应类型加聚反应.
,写出E→F的反应类型加聚反应.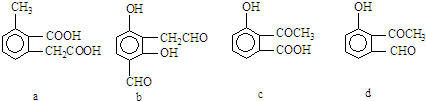
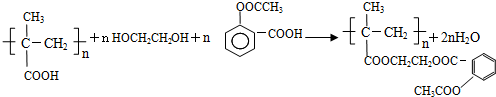 .
.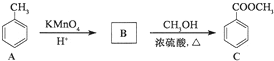
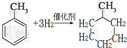 ,反应类型为加成反应.
,反应类型为加成反应.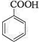 ,所得B的粗产品通常用重结晶的方法提纯.
,所得B的粗产品通常用重结晶的方法提纯.