题目内容
10.硫晶体熔化或气化时,下述各项中发生变化的是( )| A. | 化学键 | B. | 中心原子杂化类型 | ||
| C. | 分子构型 | D. | 分子间作用力 |
分析 硫晶体熔化或气化时,物质状态发生变化,只破坏分子间作用力,化学键不变,以此来解答.
解答 解:A.硫晶体熔化或气化时,由固体变成液体或气体,改变的是分子间距离和分子间作用力,发生的是物理变化,与分子内的共价键、化学性质、分子构型及中心原子杂化类型无关.
故选D.
点评 本题考查化学键类型的判断,为高频考点,题目难度不大,注意晶体的类型,分子间作用力和化学键的区别.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的2.5倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
| A. | 元素X的简单气态氢化物的热稳定性性比W的弱 | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Z的弱 | |
| C. | 原子半径的大小顺序:rY>rz>rw>rx | |
| D. | 元素Y、Z的氧化物中化学键的类型相同 |
5.氯原子M能层含有的轨道数为( )
| A. | 4 | B. | 5 | C. | 7 | D. | 9 |
15.氮的最高价氧化物为无色晶体,它由两种离子构成,已知其阴离子构型为平面三角形,则其阳离子的构型和阳离子中氮的杂化方式为( )
| A. | 直线 sp杂化 | B. | V型 sp2杂化 | ||
| C. | 三角锥形 sp3杂化 | D. | 平面三角形 sp2 杂化 |
2.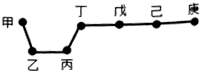 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )| A. | 甲一定是金属元素 | |
| B. | 气态氢化物的稳定性:庚>己>戊 | |
| C. | 庚的最高价氧化物的水化物酸性最强 | |
| D. | 乙、丙、丁的最高价氧化物的水化物可以以相互反应 |
19.H、C、N、O、Na、Cr是常见的六种元素.
(1)C位于元素周期表第二周期第IVA族;Cr的基态原子核外电子排布式为1s22s22p63s23p63d54s1;C2H2分子中σ键与π键数目之比为3:2.
(2)用“>”或“<”填空:
(3)25℃、101kPa下:①2Na(s)+$\frac{1}{2}$O2(g)=Na2O(s)△H=-414kJ•mol-1
②2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1
写出Na2O2与单质钠化合成Na2O固体的热化学方程式Na(s)+Na2O2(s)=2Na2O(s)△H=-317 kJ•mol-1.
(4)我国已经立法规定酒驾入列.“酒精检测仪”中有红色CeO3和少量H2SO4,检测酒驾时产物有三价铬和CO2等,该反应的化学方程式为C2H5OH+4CrO3+6H2SO4=2Cr2(SO4)3+2CO2↑+9H2O.
(1)C位于元素周期表第二周期第IVA族;Cr的基态原子核外电子排布式为1s22s22p63s23p63d54s1;C2H2分子中σ键与π键数目之比为3:2.
(2)用“>”或“<”填空:
| 电负性 | 键长 | 键的极性 | 沸点(同压) |
| C<N | C=C<C-C | N-H<O-H | 甲醇>丁烷 |
②2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1
写出Na2O2与单质钠化合成Na2O固体的热化学方程式Na(s)+Na2O2(s)=2Na2O(s)△H=-317 kJ•mol-1.
(4)我国已经立法规定酒驾入列.“酒精检测仪”中有红色CeO3和少量H2SO4,检测酒驾时产物有三价铬和CO2等,该反应的化学方程式为C2H5OH+4CrO3+6H2SO4=2Cr2(SO4)3+2CO2↑+9H2O.
20. BF3与一定量的水可形成(H2O)2•BF3晶体,结构如图所示则(H2O)2•BF3晶体中各种微粒间的作用力不涉及( )
BF3与一定量的水可形成(H2O)2•BF3晶体,结构如图所示则(H2O)2•BF3晶体中各种微粒间的作用力不涉及( )
 BF3与一定量的水可形成(H2O)2•BF3晶体,结构如图所示则(H2O)2•BF3晶体中各种微粒间的作用力不涉及( )
BF3与一定量的水可形成(H2O)2•BF3晶体,结构如图所示则(H2O)2•BF3晶体中各种微粒间的作用力不涉及( )| A. | 共价键 | B. | 离子键 | C. | 配位键 | D. | 范德华力 |
 X、Y、Z、W、Q是原子序数依次增大的前四周期元素.已知X、Y、Z、W均为非金属元素,X的基态原子由2个未成对电子,XW2分子与Y3为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题:
X、Y、Z、W、Q是原子序数依次增大的前四周期元素.已知X、Y、Z、W均为非金属元素,X的基态原子由2个未成对电子,XW2分子与Y3为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题: ;
;