题目内容
12.下列各组中化合物的性质比较,不正确的是( )| A. | 酸性:HCl04>HBr04>HI04 | B. | 碱性:Na0H>Mg(0H)2>Al(0H)3 | ||
| C. | 稳定性;PH3>H2S>HCl | D. | 非金属性:F>0>S |
分析 A.非金属性越强,最高价氧化物的水化物的酸性越强;
B.金属性越强,最高价氧化物的水化物的碱性越强;
C.非金属性越强,气态氢化物越稳定;
D.同周期从左到右非金属性增强,同主族从上到下非金属性减弱.
解答 解:A.非金属性Cl>Br>I,最高价氧化物的水化物的酸性为HCl04>HBr04>HI04,故A正确;
B.金属性Na>Mg>Al,最高价氧化物的水化物的碱性为Na0H>Mg(0H)2>Al(0H)3,故B正确;
C.非金属性Cl>S>P,气态氢化物的稳定性为PH3<H2S<HCl,故C错误;
D.同周期从左到右非金属性增强,则非金属性:F>0,同主族从上到下非金属性减弱,则非金属性:0>S,所以非金属性:F>0>S,故D正确;
故选C.
点评 本题考查元素性质的比较,为高频考点,把握元素的金属性、非金属性比较为解答的关键,注意元素的位置及元素周期律的应用,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
2.已知甲醛(HCHO)分子中的4个原子是共平面的.下列分子中所有原子不可能同时存在于同一平面上的是( )
| A. | 苯乙烯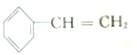 | B. | 苯甲酸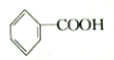 | C. | 苯甲醛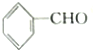 | D. | 苯乙酮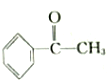 |
20.短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的2.5倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
| A. | 元素X的简单气态氢化物的热稳定性性比W的弱 | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Z的弱 | |
| C. | 原子半径的大小顺序:rY>rz>rw>rx | |
| D. | 元素Y、Z的氧化物中化学键的类型相同 |
17.一定温度下.将2molSO2和1molO2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol,当达到平衡状态时,下列说法中正确的是( )
| A. | 生成SO3 2mol | |
| B. | SO2和SO3物质的量之和一定为2mol | |
| C. | 反应放出197kJ的热量 | |
| D. | SO2的物质的量和SO3物质的量一定相等 |
2.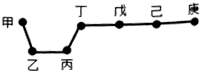 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )| A. | 甲一定是金属元素 | |
| B. | 气态氢化物的稳定性:庚>己>戊 | |
| C. | 庚的最高价氧化物的水化物酸性最强 | |
| D. | 乙、丙、丁的最高价氧化物的水化物可以以相互反应 |
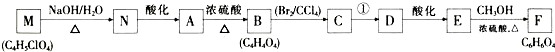
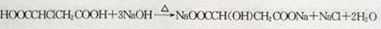 ;
;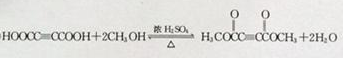 ,
,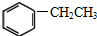 ④
④ ⑤CH3CH2CH=CH2 ⑥
⑤CH3CH2CH=CH2 ⑥