题目内容
9.化合物C是某合成路线的中间体,可通过下列方法合成: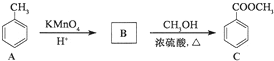
回答下列问题:
(1)在催化剂作用下,A与氢气反应的化学方程式为
 ,反应类型为加成反应.
,反应类型为加成反应.(2)B的结构简式为
 ,所得B的粗产品通常用重结晶的方法提纯.
,所得B的粗产品通常用重结晶的方法提纯.(3)在C的制备中,浓硫酸的作用是催化剂和吸水剂.
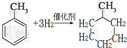
分析 (1)甲苯中的苯环与氢气能发生加成反应,生成甲基环已烷;
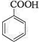
(2)比较A和C的结构简式可知,A发生氧化反应生成B为 ,根据苯甲酸在水中的溶解度与温度的关系可知苯甲酸的提纯方法;
,根据苯甲酸在水中的溶解度与温度的关系可知苯甲酸的提纯方法;
(3)苯甲酸与甲醇在浓硫酸作催化剂和吸水剂的条件下加热发生酯化反应生成C;
解答 解:(1)甲苯中的苯环与氢气能发生加成反应,生成甲基环已烷,反应的化学方程式为 ,
,
故答案为: ;加成反应;
;加成反应;
(2)比较A和C的结构简式可知,A发生氧化反应生成B为 ,根据苯甲酸在水中的溶解度与温度的关系可知苯甲酸的提纯方法是重结晶,
,根据苯甲酸在水中的溶解度与温度的关系可知苯甲酸的提纯方法是重结晶,
故答案为: ;重结晶;
;重结晶;
(3)苯甲酸与甲醇在浓硫酸作催化剂和吸水剂的条件下加热发生酯化反应生成C,
故答案为:催化剂和吸水剂.
点评 本题考查以有机物合成考查有机物结构与性质,为高频考点,涉及苯的同系物、羧酸性质的考查,把握官能团与性质的关系即可解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的2.5倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
| A. | 元素X的简单气态氢化物的热稳定性性比W的弱 | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Z的弱 | |
| C. | 原子半径的大小顺序:rY>rz>rw>rx | |
| D. | 元素Y、Z的氧化物中化学键的类型相同 |
17.一定温度下.将2molSO2和1molO2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol,当达到平衡状态时,下列说法中正确的是( )
| A. | 生成SO3 2mol | |
| B. | SO2和SO3物质的量之和一定为2mol | |
| C. | 反应放出197kJ的热量 | |
| D. | SO2的物质的量和SO3物质的量一定相等 |
19.H、C、N、O、Na、Cr是常见的六种元素.
(1)C位于元素周期表第二周期第IVA族;Cr的基态原子核外电子排布式为1s22s22p63s23p63d54s1;C2H2分子中σ键与π键数目之比为3:2.
(2)用“>”或“<”填空:
(3)25℃、101kPa下:①2Na(s)+$\frac{1}{2}$O2(g)=Na2O(s)△H=-414kJ•mol-1
②2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1
写出Na2O2与单质钠化合成Na2O固体的热化学方程式Na(s)+Na2O2(s)=2Na2O(s)△H=-317 kJ•mol-1.
(4)我国已经立法规定酒驾入列.“酒精检测仪”中有红色CeO3和少量H2SO4,检测酒驾时产物有三价铬和CO2等,该反应的化学方程式为C2H5OH+4CrO3+6H2SO4=2Cr2(SO4)3+2CO2↑+9H2O.
(1)C位于元素周期表第二周期第IVA族;Cr的基态原子核外电子排布式为1s22s22p63s23p63d54s1;C2H2分子中σ键与π键数目之比为3:2.
(2)用“>”或“<”填空:
| 电负性 | 键长 | 键的极性 | 沸点(同压) |
| C<N | C=C<C-C | N-H<O-H | 甲醇>丁烷 |
②2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1
写出Na2O2与单质钠化合成Na2O固体的热化学方程式Na(s)+Na2O2(s)=2Na2O(s)△H=-317 kJ•mol-1.
(4)我国已经立法规定酒驾入列.“酒精检测仪”中有红色CeO3和少量H2SO4,检测酒驾时产物有三价铬和CO2等,该反应的化学方程式为C2H5OH+4CrO3+6H2SO4=2Cr2(SO4)3+2CO2↑+9H2O.
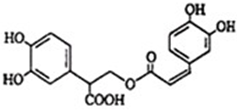 迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.请写出迭香酸中所有官能团的名称羧基、酯基、(酚)羟基、碳碳双键.
迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.请写出迭香酸中所有官能团的名称羧基、酯基、(酚)羟基、碳碳双键.
 X、Y、Z、W、Q是原子序数依次增大的前四周期元素.已知X、Y、Z、W均为非金属元素,X的基态原子由2个未成对电子,XW2分子与Y3为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题:
X、Y、Z、W、Q是原子序数依次增大的前四周期元素.已知X、Y、Z、W均为非金属元素,X的基态原子由2个未成对电子,XW2分子与Y3为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题: ;
;