题目内容
某化学研究性学习小组探究Fe3+和SO32-之间发生的反应。
(1)取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。无气泡产生,无沉淀生成。这种红褐色液体是___________________。
(2)除了观察到以上的现象外,有成员提出了另一种可能:发生氧化还原反应。反应的离子方程式为 。
研究性学习小组设计了两种实验方案证明发生了氧化还原反应。请把实验方案补充完整:
方案一:检验溶液中含有Fe2+证明发生了氧化还原反应
方案二:检验溶液中含有 证明发生了氧化还原反应
实验用品:0.1mol/L BaCl2、3mol/L盐酸、0.1mol/LKMnO4(H+)、氯水、20%KSCN、0.5mol/LKI;试管若干、胶头滴管若干
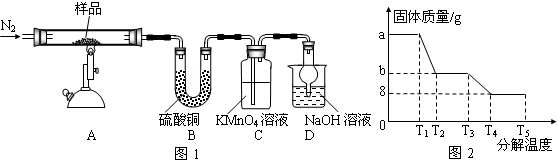
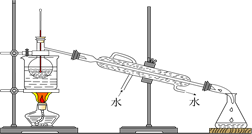
Ⅰ预处理:将(1)中获得的混合物放在如图装置中处理足够时间。
Ⅱ检验过程
| 操 作 | 现象及结论 |
| 基于方案一: | |
| 基于方案二: | |
(1)Fe(OH)3胶体 (2)2Fe3++SO32-+H2O=2Fe2++SO42-+2H+ (3)SO42-操作 现象及结论 基于方案一:取少量烧杯中的溶液于试管中,滴加20℅KSCN溶液,再加入适量氯水。 溶液开始不变色,加入氯水后变红色,证明溶液含有Fe2+ 基于方案二:取少量烧杯中的溶液于试管中,加入足量3mol/L的盐酸,再滴加0.1mol/L BaCl2溶液。 溶液加盐酸时产生刺激性气体,当加入BaCl2有白色沉淀生成,证明含有SO42-
解析试题分析:(1)FeCl3是强酸弱碱盐,水解使溶液显酸性; Na2SO3是强碱弱酸盐水解使溶液显碱性。当二者混合时,对彼此的水解起到了促进作用,所以产生了红褐色的氢氧化铁胶体。(2)如果二者混合发生氧化还原反应,则反应的两种方程式是:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+。在该反应中氧化剂Fe3+生成还原产物Fe2+;还原剂SO32-氧化为氧化产物SO42-。所以证明发生了氧化还原反应可以通过检验溶液中含有Fe2+或检验溶液中含有SO42-。方案一:利用Fe3+遇到SCN-产生血红色溶液,而Fe2+遇到SCN-不会发生反应,Fe2+遇到氯水被氧化为Fe3+后产生血红色溶液。来检验溶液中含有Fe2+。方案二:向溶液中加入足量3mol/L的盐酸使SO32-转化为SO2气体溢出,再滴加0.1mol/L BaCl2溶液,若产生白色沉淀,就证明含有SO42-。
考点:考查Fe3+和SO32-之间发生的反应的原理。

碘是人体必需的微量元素之一,有“智力元素”之称。食用加碘食盐可预防碘缺乏病。查阅资料知:①在酸性条件下,I- 能被NO3- 氧化成IO3-,被H2O2或O2等氧化为I2;② IO3- 能被HSO3- 还原成I2。
请你利用实验室常用仪器和下列限选试剂,依次研究某食盐样品中所加碘的存在形式是I2、I-、IO3- 中的哪一种。
限选试剂如下:1.0 mol?L-1HNO3溶液、1.0 mol?L-1H2SO4溶液、1.0 mol?L-1NaHSO3溶液、3%H2O2溶液、1%淀粉溶液、蒸馏水。
(1)提出假设
假设1:该食盐样品中含I2;
假设2:该食盐样品中含I-;
假设3: 。
(2)设计方案与实验探究
将适量食盐样品溶于蒸馏水制成溶液,请按要求填写下表:
| 实验步骤 | 预期现象与结论 |
| 步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液,振荡 | 若溶液显 (填颜色),则假设1成立;否则,假设1不成立,再进行步骤2 |
| 步骤2: | 若溶液显蓝色,则假设2成立,反应的离子方程式为 ;否则,假设2不成立,再进行步骤3 |
| 步骤3: | |
(3)问题与思考
纯KIO3或纯KI都可以作为食用加碘盐中碘的来源。从化学角度来看,实验中添加 (填“KIO3”或“KI”)更好,理由是 。
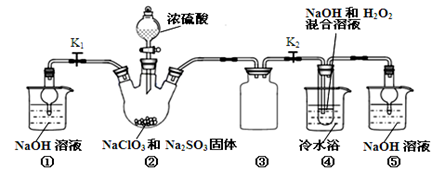
Ⅰ某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与干燥Na2CO3 固体反应得到的固体物质的成分。
已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中固体含有NaHCO3 ,且含氯的盐只有一种。现对C的成分进行猜想和探究。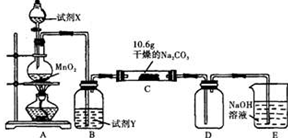
(1)提出合理猜想:若已知C中有0.1molCl2恰好和10.6克Na2CO3固体完全反应。则C中有Cl2参与反应的化学方程式可能 。
(2)①提出合理假设。
假设1:存在两种成分:NaHCO3和 ;
假设2:存在三种成分:NaHCO3和 、 。
②设计合理方案对C固体中的未知成分进行探究。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀HNO3、Ba(OH)2溶液、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量C中固体样品于试管中,加入足量蒸馏水,充分振荡至固体完全溶解,然后将所得溶液分装A、B两支试管中。 | |
| 步骤2: | |
| 步骤3: | |
| | |
①现有烧杯、玻璃棒、量筒、胶头滴管,要配制0.0150 mol/L K2Cr2O7溶液100mL,还需要的玻璃仪器是 。
②取25mL待测液进行滴定,平均消耗 K2Cr2O7溶液体积为25.00 mL,则铁矿石中铁元素的百分含量是(Fe的相对原子质量为56) 。
③在本实验的滴定过程中,下列操作会使测定结果偏小的是 (填写序号)。
a.未用标准K2Cr2O7溶液润洗滴定管
b.锥形瓶中加入待测溶液后,再加少量水
c.锥形瓶在滴定过程中剧烈摇动,有少量液体溅出
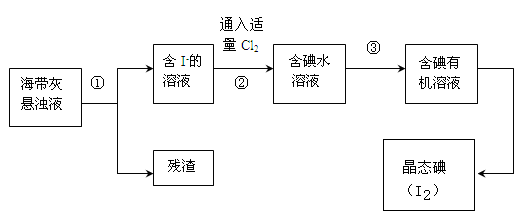
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下: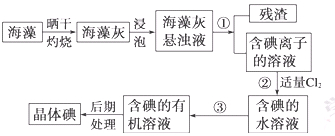
(1)指出操作③的名称: ;操作②中充入适量Cl2的目的是 。
(2)提取碘的过程中,可供选择的试剂是 ( )
| A.酒精 | B.四氯化碳 | C.汽油 | D.醋酸 |
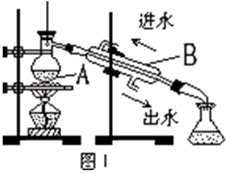
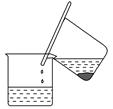
(3)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏。图I是某同学设计的蒸馏装置,图中明显的错误是 。
(4)有同学认为蒸馏时最好使用水浴加热,使用水浴的优点是: ;蒸馏结束,晶体碘聚集在 (填仪器名称)里。
(5) 实验③分离出来的废液中含有Cl–、SO42–,现只取一次试液,如何鉴别出Cl–、SO42–,依次加入试剂的为: 、 。
(6)某小组同学实验时需用到一定物质的量浓度的碘水溶液225mL,配制时需要的仪器除天平、玻璃棒、烧杯外,还需 、 。若摇匀时,发现液面低于刻度线,则配得溶液浓度(填偏大、偏小或无影响)。