题目内容
4.下面有关硅的叙述中,正确的是( )| A. | 二氧化硅在电子工业中,是最重要的半导体材料 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位 | |
| C. | 硅的化学性质不活泼,在自然界中可以以游离态存在 | |
| D. | 光导纤维是以二氧化硅为主要原料制成的 |
分析 A.二氧化硅为绝缘体;
B.硅在地壳中的含量在所有的元素中居第二位;
C.自然界中无游离态硅;
D.二氧化硅是光导纤维主要成分.
解答 解:A.二氧化硅为绝缘体,用作半导体材料的是硅,故A错误;
B.硅在地壳中的含量在所有的元素中居第二位,故B错误;
C.硅在自然界中以化合态存在,故C错误;
D.二氧化硅是光导纤维主要成分,是制备光导纤维的主要原料,故D正确;
故选:D.
点评 本题考查了硅及其化合物的性质,熟悉硅、二氧化硅的性质和用途即可解答,题目难度不大.

练习册系列答案
相关题目
12.下列排列顺序正确的是( )
| A. | 熔沸点:H2O>HF>HCl | B. | 原子半径:Mg>Na>O | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 热稳定性:H2O>HF>H2S |
12.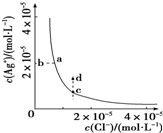 某温度时,AgCl(s)?Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
某温度时,AgCl(s)?Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
 某温度时,AgCl(s)?Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
某温度时,AgCl(s)?Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )| A. | 加入AgNO3,可以使溶液由c点变到d点 | |
| B. | 加入少量水,平衡右移,Cl-浓度减小 | |
| C. | d点没有AgCl沉淀生成 | |
| D. | c点对应的Ksp等于a点对应的Ksp |
19.下列说法正确的是( )
| A. | 自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片 | |
| B. | 工业上通常用电解钠、镁、铝对应的氯化物制得该三种金属单质 | |
| C. | Si、P、S、Cl相应的氢化物的还原性依次增强 | |
| D. | 测定相同条件下NaHCO3溶液和Na2SO4溶液的pH,判断碳与硫的非金属性强弱 |
9.关于下列各装置图的叙述中,正确的是( )
| A. | 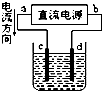 装置中,d为阳极、c为阴极 | |
| B. | 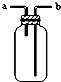 装置由a进气可用于收集H2、NH3、CO2、Cl2 等气体 | |
| C. | 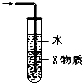 装置中X若为CCl4,可用于吸收NH3 或HCl,并可防止倒吸 | |
| D. | 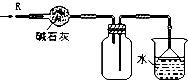 装置可用于干燥、收集HCl,并吸收多余的HCl |
16.下列离子方程式正确的是( )
| A. | 金属钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 铜粉溶于氯化铁溶液中:Cu+2Fe3+═2Fe2++Cu2+ | |
| C. | 氯气与冷氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 向氯化铝溶液中加入过量氨水:4OH-+Al3+═AlO2-+2H2O |
13.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 2.8g铁粉在1.12L(标准状态)氯气中充分燃烧,失去的电子数为0.15NA | |
| B. | 常温下,0.1mol/LHCl溶液中所含的H+个数为0.1NA | |
| C. | 11.2L 的CO气体与0.5molN2所含的电子数相等 | |
| D. | 10gH218O中所含的中子数为5NA |
14.将32g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L,则生成的NO和NO2的体积之比为( )
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 4:1 |