题目内容
1.下列反应的离子方程式书写错误的是( )| A. | 醋酸跟氢氧化钠溶液反应:CH3COOH+OH-→CH3COO-+H2O | |
| B. | 铁跟稀盐酸反应:Fe+2H+→Fe2++H2↑ | |
| C. | 在硫氢化钠溶液中加入稀硫酸溶液:S2-+2H+→H2S↑ | |
| D. | 碳酸钙溶于盐酸中:CaCO3+2H+→Ca2++H2O+CO2↑ |
分析 A.醋酸与氢氧化钠反应生成醋酸钠和水;
B.铁与稀盐酸反应生成氯化亚铁和氢气;
C.硫氢根离子不能拆开,应该两边整体形式;
D.碳酸钙与稀盐酸反应生成氯化钙、二氧化碳气体和水.
解答 解:A.醋酸跟氢氧化钠溶液反应的离子方程式为:CH3COOH+OH-→CH3COO-+H2O,故A正确;
B.铁跟稀盐酸反应生成氯化亚铁和氢气,反应的离子方程式为:Fe+2H+→Fe2++H2↑,故B正确;
C.在硫氢化钠溶液中加入稀硫酸溶液,正确的离子方程式为:HS-+H+→H2S↑,故C错误;
D.碳酸钙溶于盐酸中,二者反应生成氯化钙、二氧化碳气体和水,反应的离子方程式为:CaCO3+2H+→Ca2++H2O+CO2↑,故D正确;
故选C.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
11.某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺流程如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Mg2+):
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO42-形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀是溶液的pH如下:
(1)实验室用18.4mol•L-1的浓硫酸配制250mL 4.8mol•L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需量筒、250mL容量瓶、胶头滴管;
(2)滤渣II是Fe(OH)3、Al(OH)3,过滤II步骤能否省略,为什么?
不能,当pH=8时,Al3+已经完全转化为沉淀,若不经过滤除去,当继续加入NaOH时,Al(OH)3会溶解,引入杂质离子AlO2-.
(3)写出滤液中加入H2O2发生反应的两种方程式2Cr3++3H2O2+H2O=Cr2O72-+8H;
(4)取得到的Na2CrO4晶体0.48g,加入硫酸溶液得到Na2CrO溶液,用0.3000 mol•L-1滴定至终点时(铬被还原为Cr3+),消耗20.00mL标准溶液.
①盛装FeSO4标准溶液应用酸式滴定管(填“酸式”或“碱式”),滴定时的操作为:左手控制活塞,右手震荡锥形瓶,眼睛注视锥形瓶内颜色变化,滴定至终点时,记录标准液的体积;
②计算该产品中Na2CrO4的质量分数为66.67%.

已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO42-形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀是溶液的pH如下:
| 阳 | Fe | Mg | Al | Cr |
| 开始沉淀时的H | 1.9 | 9.0 | -- | -- |
| 沉淀完全时的H | 3. | 11.1 | 8 | 9 (>9溶解) |
(2)滤渣II是Fe(OH)3、Al(OH)3,过滤II步骤能否省略,为什么?
不能,当pH=8时,Al3+已经完全转化为沉淀,若不经过滤除去,当继续加入NaOH时,Al(OH)3会溶解,引入杂质离子AlO2-.
(3)写出滤液中加入H2O2发生反应的两种方程式2Cr3++3H2O2+H2O=Cr2O72-+8H;
(4)取得到的Na2CrO4晶体0.48g,加入硫酸溶液得到Na2CrO溶液,用0.3000 mol•L-1滴定至终点时(铬被还原为Cr3+),消耗20.00mL标准溶液.
①盛装FeSO4标准溶液应用酸式滴定管(填“酸式”或“碱式”),滴定时的操作为:左手控制活塞,右手震荡锥形瓶,眼睛注视锥形瓶内颜色变化,滴定至终点时,记录标准液的体积;
②计算该产品中Na2CrO4的质量分数为66.67%.

12. 某温度时,AgCl(s)?Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
某温度时,AgCl(s)?Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
 某温度时,AgCl(s)?Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
某温度时,AgCl(s)?Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )| A. | 加入AgNO3,可以使溶液由c点变到d点 | |
| B. | 加入少量水,平衡右移,Cl-浓度减小 | |
| C. | d点没有AgCl沉淀生成 | |
| D. | c点对应的Ksp等于a点对应的Ksp |
9.关于下列各装置图的叙述中,正确的是( )
| A. | 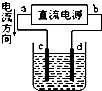 装置中,d为阳极、c为阴极 | |
| B. | 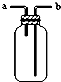 装置由a进气可用于收集H2、NH3、CO2、Cl2 等气体 | |
| C. | 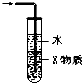 装置中X若为CCl4,可用于吸收NH3 或HCl,并可防止倒吸 | |
| D. | 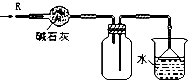 装置可用于干燥、收集HCl,并吸收多余的HCl |
16.下列离子方程式正确的是( )
| A. | 金属钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 铜粉溶于氯化铁溶液中:Cu+2Fe3+═2Fe2++Cu2+ | |
| C. | 氯气与冷氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 向氯化铝溶液中加入过量氨水:4OH-+Al3+═AlO2-+2H2O |
6.用标准盐酸滴定未知浓度的NaOH溶液,下列有关实验操作的说法正确的是( )
| A. | 用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 | |
| B. | 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,而后装入一定体积的NaOH溶液 | |
| C. | 滴定过程中视线应一直注视锥形瓶内混合液颜色的变化 | |
| D. | 用酚酞做指示剂,溶液由无色变浅红色,半分钟不变色为滴定终点 |
13.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 2.8g铁粉在1.12L(标准状态)氯气中充分燃烧,失去的电子数为0.15NA | |
| B. | 常温下,0.1mol/LHCl溶液中所含的H+个数为0.1NA | |
| C. | 11.2L 的CO气体与0.5molN2所含的电子数相等 | |
| D. | 10gH218O中所含的中子数为5NA |
10.若NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1mol Cl2作为氧化剂得到的电子数为NA | |
| B. | 在0℃101kPa时,22.4L氢气中含有NA个氢原子 | |
| C. | NA个一氧化碳分子和0.5mol甲烷的质量比为7:4 | |
| D. | 14g 氮气中含有7NA个电子 |
11.唾液淀粉酶的作用是( )
| A. | 催化淀粉水解为葡萄糖 | B. | 催化淀粉水解为麦芽糖 | ||
| C. | 催化麦芽糖水解为葡萄糖 | D. | 催化葡萄糖合成为淀粉 |