题目内容
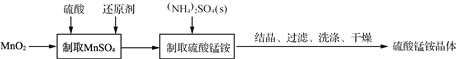
【题目】硫酸锰铵晶体可用作织物和木材加工的防火剂等。由二氧化锰等作原料制取硫酸锰铵晶体步骤如下:
(1)实验前,需称量MnO2的质量,这是因为____________________________。
(2) “制取MnSO4”时,可用C6H12O6(葡萄糖)、H2C2O4(草酸)等物质作还原剂。
①用C6H12O6作还原剂(被氧化为CO2)时,发生反应的n(MnO2)/n(C6H12O6)=________。
②用H2C2O4作还原剂,发生反应的化学方程式为____________________________。
(3)一种测定硫酸锰铵晶体[设为: (NH4)xMny(SO4)z·wH2O]组成的方法如下:
①称取一定量的硫酸锰铵晶体配成250 mL溶液A。
②取25.00 mL溶液A加入足量的BaCl2溶液得BaSO4 0.512 6 g。
③另取25.00 mL溶液A加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min[4NH![]() +6HCHO===3H++6H2O+(CH2)6N4H+,滴定时,1 mol(CH2)6N4H+与1 mol H+相当],加入1~2滴酚酞溶液,用0.100 0 mol·L-1 NaOH标准溶液滴定至终点(在该过程中Mn2+不沉淀),消耗NaOH溶液22.00 mL。
+6HCHO===3H++6H2O+(CH2)6N4H+,滴定时,1 mol(CH2)6N4H+与1 mol H+相当],加入1~2滴酚酞溶液,用0.100 0 mol·L-1 NaOH标准溶液滴定至终点(在该过程中Mn2+不沉淀),消耗NaOH溶液22.00 mL。
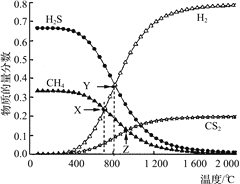
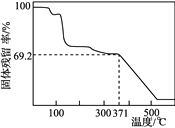
④取一定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如右图所示(样品在371 ℃时已完全失去结晶水)。根据以上实验数据计算确定硫酸锰铵晶体的化学式(写出计算过程)。__________________
【答案】 确定制备硫酸锰铵时应加入硫酸、还原剂及(NH4)2SO4的质量 12 MnO2 +H2C2O4+H2SO4===MnSO4+2CO2↑+2H2O n(SO![]() ) =n(BaSO4) =
) =n(BaSO4) =![]() =2.200×10-3 mol,NH
=2.200×10-3 mol,NH![]() ) =n(NaOH)=0.100 0 mol·L-1×22.00 mL×10-3 L·mL-1=2.200×10-3 mol,(Mn2+)=
) =n(NaOH)=0.100 0 mol·L-1×22.00 mL×10-3 L·mL-1=2.200×10-3 mol,(Mn2+)=![]() [2 n(SO
[2 n(SO![]() )-n(NH
)-n(NH![]() )]=1.100×10-3 mol,x∶y∶z=2∶1∶2,化学式为(NH4)2Mn(SO4)2·wH2O,
)]=1.100×10-3 mol,x∶y∶z=2∶1∶2,化学式为(NH4)2Mn(SO4)2·wH2O,![]() =69.2% w=7,化学式为(NH4)2Mn(SO4)2·7H2O
=69.2% w=7,化学式为(NH4)2Mn(SO4)2·7H2O
【解析】(1)实验前需要称量MnO2的质量,以确定应加入硫酸、还原剂及(NH4)2SO4的质量;
(2) ①用C6H12O6作还原剂(被氧化为CO2)时,根据电子转移守恒可推出,Mn降低2价,C升高6×4价,所以发生反应的n(MnO2)/n(C6H12O6)=12;②用H2C2O4作还原剂时,反应的化学方程式为MnO2+H2C2O4+H2SO4=MnSO4+2CO2↑+2H2O
(3)根据BaSO40.5126g可得n(SO42-)=n(BaSO4)= ![]() =2.200×10-3mol,n(NH4+)= n(NaOH) = 0.1000mol·L-1×22.00mL×10-3L·mL-1=2.200×10-3mol,由电荷守恒可得n(Mn2+)=
=2.200×10-3mol,n(NH4+)= n(NaOH) = 0.1000mol·L-1×22.00mL×10-3L·mL-1=2.200×10-3mol,由电荷守恒可得n(Mn2+)= ![]() [2n(SO42-)- n(NH4+)]=1.100×10-3mol,所以x:y:z =2:1:2,设该物质的化学式为(NH4)2Mn(SO4)2·wH2O,则由图象可得
[2n(SO42-)- n(NH4+)]=1.100×10-3mol,所以x:y:z =2:1:2,设该物质的化学式为(NH4)2Mn(SO4)2·wH2O,则由图象可得 ![]() = 69.2% w=7,化学式为(NH4)2Mn(SO4)2·7H2O。
= 69.2% w=7,化学式为(NH4)2Mn(SO4)2·7H2O。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案【题目】硫氰酸盐、苯酚及硫代硫酸盐是HPF脱硫废液中的主要污染物(其中还含有Cl-、SO![]() 、Na+等),可用NaClO3、H2SO4作脱除的试剂。
、Na+等),可用NaClO3、H2SO4作脱除的试剂。
(1)Cl2与热的NaOH溶液反应生成NaClO3,该反应的化学方程式为____________________________。
(2) 常温时,反应C6H5O-+H2O ![]() C6H5OH+OH-的平衡常数为K=________(C6H5OH的Ka=1×10-10)。
C6H5OH+OH-的平衡常数为K=________(C6H5OH的Ka=1×10-10)。
(3)处理该废水需经预处理和再处理阶段。
①用浓硫酸对600 mL HPF脱硫废液进行酸化预处理(反应温度100℃),其结果如表1所示:
表1 预处理前后三种离子浓度变化情况
项目 | S2O | SCN-(g·L-1) | 苯酚(g·L-1) | pH |
处理前 | 34.28 | 70.11 | 1.3 | 8.55 |
处理后 | 0.91 | 69.76 | 1.35 | 2.4 |
由表1可知,该处理过程中主要被除去的污染物是________。
②对预处理后废液进行再处理(反应温度100 ℃)时,13次依次向废液中加入试剂情况如表2所示:
表2 13次依次加入试剂情况
次数 | 1 | 2 | 3 | 4 | span>5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
NaClO3/g | 16.3 | 0 | 0 | 0 | 0 | 0 | 7.6 | 0 | 5.7 | 0 | 10.9 | 0 | 7.1 |
浓H2SO4/mL | 0 | 2 | 2 | 2 | 4 | 4 | 0 | 4 | 0 | 4 | 0 | 4 | 0 |
实验结果如图1所示:
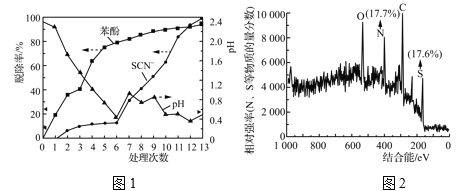
前![]() 和Cl-反应产生Cl2有关。该白色沉淀可能的结构简式为______________。
和Cl-反应产生Cl2有关。该白色沉淀可能的结构简式为______________。
③由表2和图1中数据得出,第7~13次操作中SCN-在较强酸性条件下被ClO![]() (不水解)氧化的依据是________。此过程中产生大量砖红色沉淀(夹杂少量白色沉淀),对沉淀进行XPS分析,部分元素的物质的量分数如图2所示。已知SCN-可被某些氧化剂(如Cu2+等)最终氧化为砖红色的沉淀(SCN)x。一种推测认为该实验中产生的砖红色沉淀为(SCN)x,支持该推测的证据有:________。
(不水解)氧化的依据是________。此过程中产生大量砖红色沉淀(夹杂少量白色沉淀),对沉淀进行XPS分析,部分元素的物质的量分数如图2所示。已知SCN-可被某些氧化剂(如Cu2+等)最终氧化为砖红色的沉淀(SCN)x。一种推测认为该实验中产生的砖红色沉淀为(SCN)x,支持该推测的证据有:________。