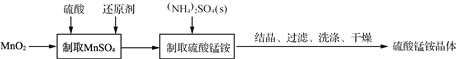
题目内容
【题目】在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为Na3AlF6 ,其中含有_______________________________等化学键。
(2)生成物中含有10个电子的分子是________(写分子式),该分子的空间构型_______,中心原子的杂化方式为___________________。
(3)反应物中所含元素电负性最大的元素为________(填元素符号),写出其原子最外层的电子排布图:_______________,它的氢化物的沸点比同主族其它氢化物的沸点高,原因是:_______________________________。
(4)冰晶石由两种微粒构成,它的晶胞结构如图甲所示,小黑点“●”位于大立方体的顶点和面心,小圆圈“○”位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处小三角“”所代表的是__________(填“小黑点”或“小圆圈”),它代表的是______________(填微粒化学式)。
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:
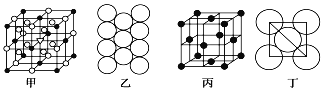
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___________个; Al晶体的密度为__________(用字母表示)。
【答案】 离子键、共价键、配位键 H2O V形 sp3 F ![]() HF的分子之间存在氢键 小圆圈 Na+ 4
HF的分子之间存在氢键 小圆圈 Na+ 4 ![]()
【解析】(1)冰晶石的化学式为Na3AlF6 ,AlF63+中含有共价键、配位键,故Na3AlF6中存在离子键、共价键和配位键;(2)生成物有Na3AlF6、CO2、H2O,其中含有10个电子的分子是H2O;H2O中O原子的价层电子对个数=2+![]() (6-2×1)=4且含有2个孤电子对,所以O原子采用sp3杂化,其空间构型为V形结构;(3)反应物有Al(OH)3、HF、Na2CO3,含有的元素有Al、Na、C、H、O、F,周期表从上到下,元素的电负性逐渐变小,从左到右,元素的电负性逐渐变大,则其中所含元素电负性最大的元素为F,F原子最外层的电子排布图为:
(6-2×1)=4且含有2个孤电子对,所以O原子采用sp3杂化,其空间构型为V形结构;(3)反应物有Al(OH)3、HF、Na2CO3,含有的元素有Al、Na、C、H、O、F,周期表从上到下,元素的电负性逐渐变小,从左到右,元素的电负性逐渐变大,则其中所含元素电负性最大的元素为F,F原子最外层的电子排布图为:![]() ,HF的分子之间存在氢键,故其沸点比同主族其它氢化物的沸点高;(4)冰晶石中Na+与AlF63-的个数比应为3:1,由晶胞图分析,“●”个数为
,HF的分子之间存在氢键,故其沸点比同主族其它氢化物的沸点高;(4)冰晶石中Na+与AlF63-的个数比应为3:1,由晶胞图分析,“●”个数为![]() ,“○”个数为
,“○”个数为![]() ,故晶胞中心还应有1个,据此可推知,“”为Na+;那么大立方体的体心处小三角“”所代表的是小圆圈,它代表的是Na+;(4)铝晶胞的原子处于晶胞顶点和面心,故一个晶胞含有的Al原子数目为
,故晶胞中心还应有1个,据此可推知,“”为Na+;那么大立方体的体心处小三角“”所代表的是小圆圈,它代表的是Na+;(4)铝晶胞的原子处于晶胞顶点和面心,故一个晶胞含有的Al原子数目为![]() ;设Al晶胞的边长为a,则有:2a2=(4d)2,a=2
;设Al晶胞的边长为a,则有:2a2=(4d)2,a=2![]() d,Al晶胞的体积为V=16
d,Al晶胞的体积为V=16![]() d3 ,故Al晶体的密度为
d3 ,故Al晶体的密度为![]() 。
。

【题目】酸性 KMnO4 溶液能与草酸(H2C2O4)溶液反应。某化学探究小组利用反应过程中溶液紫色消失快慢的 方法来研究影响反应速率的因素。
I.实验前首先用浓度为 0.1000 mol/L 酸性 KMnO4 标准溶液滴定未知浓度的草酸溶液。
(1)写出滴定过程中发生反应的离子方程式 。
(2)下列有关一定物质的量浓度溶液配制的说法中正确的是 。
A.把 15.8 g KMnO4 固体溶于 1 L 水中所得溶液物质的量浓度为 0.1 mol/L
B.把 0.01 mol KMnO4 固体投入 100 mL 容量瓶中加水至刻度线,充分振荡后,浓度为 0.1 mol/L
C.需要 90 mL 0.1 mol/L 的 KMnO4 溶液,应准确称量 KMnO4 固体 1 58 g
D.定容时仰视容量瓶颈刻度线读数,会使配制的溶液浓度偏高
II.通过滴定实验得到草酸溶液的浓度为 0.2000 mol/L。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为 8.00 mL)。
实验编号 | 温度(℃) | 催化剂用量(g) | 酸性高锰酸钾 溶液 | |
体积(mL) | 浓度(mol/L) | |||
1 | 25 | 0.5 | 4.00 | 0.1000 |
2 | 50 | 0.5 | 4.00 | 0.1000 |
3 | 25 | 0.5 | 4.00 | 0.0100 |
4 | 25 | 0 | 4.00 | 0.1000 |
(3)写出表中实验 1 和实验 2 的实验目的: 。
(4)该小组同学对实验 1 和实验 3 分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验 编号 | 溶液褪色所需时间 (min) | ||
第 1 次 | 第 2 次 | 第 3 次 | |
1 | 14.0 | 13.0 | 11.0 |
2 | 6.5 | 6.7 | 6.8 |
分析上述数据后得出“其他条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。甲同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,甲同学改进了实验方案,请简述甲同学改进 的实验方案______________。
(5)该实验中使用的催化剂应选择 MnSO4 并非 MnCl2,原因可用离子方程式表示为________。
III.工业上可用软锰矿(主要成分为 MnO2)经下列生产过程制备高锰酸钾。
①由软锰矿提取得到 MnO2,然后在 MnO2、KOH 的熔融混合物中通入空气可制得锰酸钾(K2MnO4);
②向锰酸钾溶液中通入CO2可获得高锰酸钾。
(6)第①步生产过程中,在熔融混合物中通入空气时发生反应的化学方程式:______________。
(7)向锰酸钾溶液中通入CO2可获得高锰酸钾,该反应中氧化产物与还原产物的物质的量之比为________________。