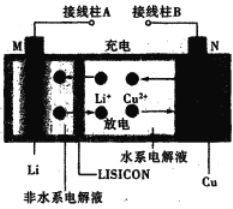
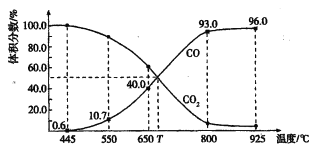
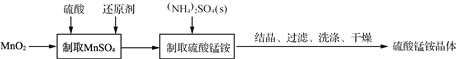
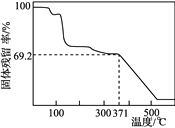
题目内容
【题目】在标准状况下,一个充满Cl2的恒容密闭容器的质量为74.6 g,若改充满N2,其质量为66 g,则容器的容积为:
A.5.6LB.11.2LC.2.24LD.4.48L
【答案】D
【解析】
设容器的质量为m,根据同温、同压,同体积的任何气体含有相同的分子数,则有(74.6-m)÷71=(66-m)÷28,解得m=60.4g,Cl2的物质的量为(74.6-60.4)÷71=0.2mol,体积为V=0.2mol×22.4L/mol=4.48L,答案选D。

【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:
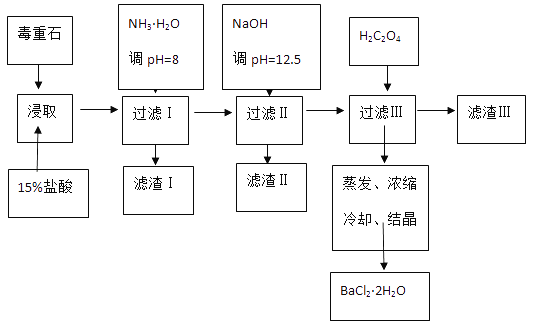
(1)实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的_________。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3H2O调节pH=8可除去_______(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是___________。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
向BaC2O4悬浊液中加入CaCl2,可发生沉淀的部分转化,请写出反应过程中的离子方程式___________________,计算该反应的平衡常数K=___________(Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,保留一位小数)
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。已知:2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移动x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b molL-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b molL-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。根据上述数据,可计算出BaCl2溶液浓度为_________molL-1(用含字母的式子表示)。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则Ba2+浓度的测量值将_______(填“偏大”或“偏小”)。
【题目】下列物质的分类组合中正确的是
A | B | C | D | |
强电解质 | Cu(OH)2 | KCl | HCl | CaCO3 |
弱电解质 | NaOH | NH3H2O | BaSO4 | CH3COOH |
非电解质 | SO2 | 金刚石 | NH3 | C2H5OH |
导电物质 | 石墨 | 稀H2SO4 | 熔融KCl | 铜 |
A. A B. B C. C D. D