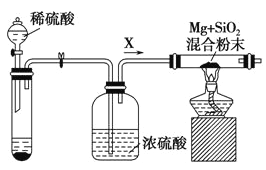
题目内容
【题目】为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
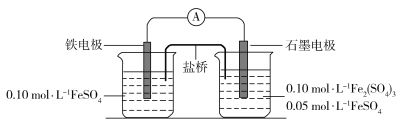
回答下列问题:
(1)由FeSO4·7H2O固体配制0.10 mol·L1 FeSO4溶液,需要的仪器有药匙、玻璃棒、_________(从下列图中选择,写出名称)。

(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择____________作为电解质。
阳离子 | u∞×108/(m2·s1·V1) | 阴离子 | u∞×108/(m2·s1·V1) |
Li+ | 4.07 |
| 4.61 |
Na+ | 5.19 |
| 7.40 |
Ca2+ | 6.59 | Cl | 7.91 |
K+ | 7.62 |
| 8.27 |
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入________电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=________。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为_______,铁电极的电极反应式为_______。因此,验证了Fe2+氧化性小于________,还原性小于________。
(6)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是_______。
【答案】烧杯、量筒、托盘天平 KCl 石墨 0.09mol/L Fe3++e-=Fe2+ Fe-2e-=Fe2+ Fe3+ Fe 取活化后溶液少许于试管中,加入KSCN溶液,若溶液不出现血红色,说明活化反应完成
【解析】
(1)根据物质的量浓度溶液的配制步骤选择所用仪器;
(2)~(5)根据题给信息选择合适的物质,根据原电池工作的原理书写电极反应式,并进行计算,由此判断氧化性、还原性的强弱;
(6)根据刻蚀活化的原理分析作答。
(1)由FeSO4·7H2O固体配制0.10mol·L-1FeSO4溶液的步骤为计算、称量、溶解并冷却至室温、移液、洗涤、定容、摇匀、装瓶、贴标签,由FeSO4·7H2O固体配制0.10mol·L-1FeSO4溶液需要的仪器有药匙、托盘天平、合适的量筒、烧杯、玻璃棒、合适的容量瓶、胶头滴管,故答案为:烧杯、量筒、托盘天平。
(2)Fe2+、Fe3+能与![]() 反应,Ca2+能与
反应,Ca2+能与![]() 反应,FeSO4、Fe2(SO4)3都属于强酸弱碱盐,水溶液呈酸性,酸性条件下
反应,FeSO4、Fe2(SO4)3都属于强酸弱碱盐,水溶液呈酸性,酸性条件下![]() 能与Fe2+反应,根据题意“盐桥中阴、阳离子不与溶液中的物质发生化学反应”,盐桥中阴离子不可以选择
能与Fe2+反应,根据题意“盐桥中阴、阳离子不与溶液中的物质发生化学反应”,盐桥中阴离子不可以选择![]() 、
、![]() ,阳离子不可以选择Ca2+,另盐桥中阴、阳离子的迁移率(u∞)应尽可能地相近,根据表中数据,盐桥中应选择KCl作为电解质,故答案为:KCl。
,阳离子不可以选择Ca2+,另盐桥中阴、阳离子的迁移率(u∞)应尽可能地相近,根据表中数据,盐桥中应选择KCl作为电解质,故答案为:KCl。
(3)电流表显示电子由铁电极流向石墨电极,则铁电极为负极,石墨电极为正极,盐桥中阳离子向正极移动,则盐桥中的阳离子进入石墨电极溶液中,故答案为:石墨。
(4)根据(3)的分析,铁电极的电极反应式为Fe-2e-=Fe2+,石墨电极上未见Fe析出,石墨电极的电极反应式为Fe3++e-=Fe2+,电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02mol/L,根据得失电子守恒,石墨电极溶液中c(Fe2+)增加0.04mol/L,石墨电极溶液中c(Fe2+)=0.05mol/L+0.04mol/L=0.09mol/L,故答案为:0.09mol/L。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为Fe3++e-=Fe2+,铁电极的电极反应式为Fe-2e-=Fe2+;电池总反应为Fe+2Fe3+=3Fe2+,根据同一反应中,氧化剂的氧化性强于氧化产物、还原剂的还原性强于还原产物,则验证了Fe2+氧化性小于Fe3+,还原性小于Fe,故答案为:Fe3++e-=Fe2+ ,Fe-2e-=Fe2+ ,Fe3+,Fe。
(6)在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化,发生的反应为Fe+ Fe2(SO4)3=3FeSO4,要检验活化反应完成,只要检验溶液中不含Fe3+即可,检验活化反应完成的方法是:取活化后溶液少许于试管中,加入KSCN溶液,若溶液不出现血红色,说明活化反应完成,故答案为:取活化后溶液少许于试管中,加入KSCN溶液,若溶液不变红,说明活化反应完成。

【题目】三氯乙醛是基本有机合成原料之一,是生产农药、医药的重要中间体。某化学兴趣小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。

查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
回答下列问题:
(1)仪器E的名称是____,冷凝水的流向是____口进水(填“a”或“b”)。
(2)有同学认为该装置存在一处缺陷,应在BC之间加一干燥装置,理由是____。
(3)该装置C控制反应温度在70℃左右,可采用____加热的方法;
(4)装置D干燥管的作用为____,装置D烧杯中的试剂是____。
(5)反应结束后,从C中的混合物中分离出Cl3CCOOH的方法是(填名称)____。