题目内容
3.实验室用锌粒与20ml浓度为2mol/L的稀硫酸反应制取氢气,若向反应混合物中加入下列物质,下列关于化学反应速率说法正确的是( )| A. | 少量NaNO3固体,v(H2)减小 | B. | 20mL BaCl2溶液,v(H2)不变 | ||
| C. | 少量NaHSO4固体,v(H2)不变 | D. | 改用18mol/L的硫酸,v(H2)增大 |
分析 对应锌与稀硫酸的反应,增大固体表面积,适当增大稀硫酸浓度、升高温度以及形成原电池反应等,都可增大反应速率,注意浓硫酸、硝酸的性质,以此解答.
解答 解:A、加入少量NaNO3固体,产生硝酸,生成氮的氧化物,生成氢气的速率减慢,故A正确;
B、加入溶液,氢离子浓度减小,生成氢气速率减慢,故B错误;
C、加入硫酸氢钠,氢离子浓度增大,生成氢气的速率加快,故C错误;
D、浓硫酸与Zn反应不生成氢气,故D错误;
故选A.
点评 本题考查影响化学反应速率的因素,注意温度、浓度、压强、接触面积、原电池反应等对反应速率的影响即可解答,难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
13.25℃时,浓度均为0.1mol/L的溶液,其pH如下表所示.有关说法正确的是( )
| 序号 | ① | ② | ③ | ④ |
| 溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
| pH | 7.0 | 7.0 | 8.1 | 8.4 |
| A. | 酸性强弱:H2CO3>HF | |
| B. | ①和②中溶质均未水解 | |
| C. | 离子的总浓度:①>③ | |
| D. | ④中:c(HCO3-)+2c(CO32-)+c(H2CO3)═0.1 mol/L |
14.下列根据实验操作和现象所得出的结论正确的是下列根据实验操作和现象所得出的结论正确的是
( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 生成白色沉淀 | 该溶液中一定含有SO42- |
| B | 将少量的溴水滴入FeCl2、NaI的混合溶液中, 再滴加CCl4,振荡、静置,向上层溶液中滴 加KSCN溶液.再向上层溶液中滴加溴水 | 实验现象1: 上层溶液不变红, 下层溶液紫红色 实验现象2: 上层溶液变红 | 氧化性: Br2>Fe3+>I2 |
| C | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| D | 浓度相同的ZnCl2、CuCl2溶液中,滴入少量Na2S溶液 | 只有黑色沉淀 | Ksp(CuS)>Ksp(ZnS) |
| A. | A | B. | B | C. | C | D. | D |
11.下列电子式正确的是( )
| A. | H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- | |
| B. | Na+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H]- | |
| C. | ${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{C}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ | |
| D. | 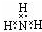 |
18.下列说法正确的是( )
| A. | 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 | |
| B. | 乳酸薄荷醇酯(如图 )能发生水解、氧化、消去反应、以及与氢气的加成反应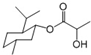 | |
| C. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| D. | 乙醛和丙烯醛(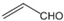 )不是同系物,它们与氢气充分反应后的产物是同系物 )不是同系物,它们与氢气充分反应后的产物是同系物 |
8.如表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)除稀有气体外,元素中原子半径最大的是K,其离子的结构示意图为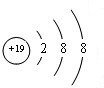
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是NaOH,呈两性的氢氧化物是Al(OH)3;
(3)按要求写出下列两种物质的电子式:①的氢化物的结构式为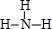 ; ②、⑦的氢化物的沸点更高的是HF;原因是HF分子之间存在氢键.
; ②、⑦的氢化物的沸点更高的是HF;原因是HF分子之间存在氢键.
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
| 主 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是NaOH,呈两性的氢氧化物是Al(OH)3;
(3)按要求写出下列两种物质的电子式:①的氢化物的结构式为
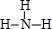 ; ②、⑦的氢化物的沸点更高的是HF;原因是HF分子之间存在氢键.
; ②、⑦的氢化物的沸点更高的是HF;原因是HF分子之间存在氢键.(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
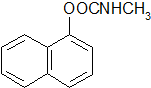 )的流程如下:
)的流程如下:
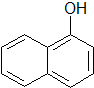 ),所需的试剂是氯化铁溶液或浓溴水.T℃,a mol/L萘酚溶液的pH=b,则该温度下萘酚的电离平衡常数K=$\frac{1{0}^{-2b}}{a-1{0}^{-b}}$.
),所需的试剂是氯化铁溶液或浓溴水.T℃,a mol/L萘酚溶液的pH=b,则该温度下萘酚的电离平衡常数K=$\frac{1{0}^{-2b}}{a-1{0}^{-b}}$.
 )有还原性,易被氧化;
)有还原性,易被氧化; .
.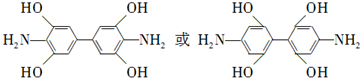 .
. )是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
)是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下: