题目内容
8.下列各组物质最简式相同,但既不是同系物,又不是同分异构体的是( )| A. | CH3CH═CH2和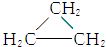 | B. | 乙炔和苯 | C. | 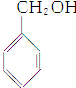 和 和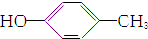 | D. | 乙酸和甲酸甲酯 |
分析 根据结构相似,组成相差n个CH2原子团的有机物,互为同系物;分子式相同,但结构不同的有机物,属于同分异构体,据此解答.
解答 解:A、CH3CH═CH2和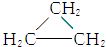 分子式相同均为C3H6,结构不同,属于同分异构体,故A不选;
分子式相同均为C3H6,结构不同,属于同分异构体,故A不选;
B、乙炔含有碳碳三键,属于炔烃,苯为芳香烃,两者分子式不同,结构不同,既不是同系物也不是同分异构体,故B选;
C、 和
和 分子式相同,均是C7H8O,结构不同,属于同分异构体,故C不选;
分子式相同,均是C7H8O,结构不同,属于同分异构体,故C不选;
D、乙酸和甲酸甲酯,分子式相同,均是C2H4O2,结构不同,属于同分异构体,故D不选,
故选B.
点评 本题考查有机物的官能团及同系物、同分异构体,注意能根据名称写出分子式或结构简式和概念的辨析,题目难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
18.若用M代替任意一种元素的符号,那么在①${\;}_{a}^{x}$M ②${\;}_{b}^{x}$M ③${\;}_{a}^{y}$M ④${\;}_{c}^{y}$M四种原子中可互称为同位素的是( )
| A. | ①和③ | B. | ②和③ | C. | ①和② | D. | ②和④ |
19.下列叙述正确的是( )
| A. | 在共价化合物中一定存在共价键 | |
| B. | 只存在共价键的物质一定是共价化合物 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 离子化合物中只含有离子键 |
16.下列实验操作能达到实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 检验蔗糖水解产物中的葡萄糖 | 取1mL 20%蔗糖溶液,加入少量稀硫酸,水浴加热后取少量溶液于另一试管中,加入几滴新制Cu(OH)2,加热 |
| B | 除去乙烷中混有的少量乙烯 | 将混合气体通入足量酸性KMnO4溶液中 |
| C | 检验葡萄糖中含有醛基 | 向3mL 2%氨水溶液中加入几滴2%的硝酸银溶液,再加入1mL10%的葡萄糖溶液温水浴加热几分钟 |
| D | 验证蛋白质的盐析 | 向豆浆、鸡蛋清溶液中均滴加饱和硫酸铵溶液,振荡至出现沉淀,再向沉淀物中加入蒸馏水,不断振荡 |
| A. | A | B. | B | C. | C | D. | D |
3.对于Zn与稀硫酸的反应,下列叙述不正确的是( )


| A. | 反应过程中能量关系可用如图表示: | |
| B. | 若将该反应设计成原电池,锌为负极 | |
| C. | 若将该反应设计成原电池,正极可用石墨 | |
| D. | 若将其设计为原电池,当有32.5 g锌溶解时,正极放出的气体一定为11.2 L |
13.不论以何种比例混合,只要混合物的质量一定,完全燃烧后生成CO2的量也一定的一组物质是( )
| A. | 甲苯和乙苯 | B. | 乙烯和丁烯 | C. | 甲烷和丙烯 | D. | 乙炔和丁炔 |
20.下列不能证明反应N2(g)+3H2(g)?2NH3(g)已达到化学反应的限度的是( )
| A. | v正(NH3)=3v逆(H2) | |
| B. | 1个N≡N键断裂的同时有6个N-H键断裂 | |
| C. | 反应体系压强不再变化 | |
| D. | 混合气体质量不再变化 |
17.元素在周期表中的位置,能反映原子结构和元素的化学性质,下列有关说法正确的是( )
| A. | 由长、短周期元素共同组成的元素族称为主族 (除零族外) | |
| B. | 同一元素不可能既表现金属性,又表现非金属性 | |
| C. | 短周期元素原子形成简单离子后,最外层电子都达到8电子稳定结构 | |
| D. | 互为同位素的不同核素,物理性质和化学性质都不同 |
5.氮氧化物是大气污染物之一,消除氮氧化物的方法有多种.
(1)利用甲烷催化还原氮氧化物.已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
则CH4将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol.
(2)利用NH3催化还原氮氧化物的技术叫SCR技术,该技术是目前应用最广泛的烟气氮氧化物脱除技术.反应的化学方程式为2NH3(g)+NO(g)+NO2(g)$\frac{\underline{\;催化剂\;}}{\;}$2N2(g)+3H2O(g)△H<0.为提高氮氧化物的转化率可采取的措施是增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等(写出一条即可).
(3)利用ClO2氧化氮氧化物,其转化流程如下:NO$→_{反应Ⅰ}^{ClO_{2}}$NO2$→_{反应Ⅱ}^{Na2SO3}$N2.已知反应Ⅰ的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,则反应Ⅱ的化学方程式是2NO2+4Na2SO3═N2+4Na2SO4;若生成11.2LN2(标准状况),则消耗ClO267.5g.
(4)用活性碳还原法处理氮氧化物,有关反应为C(s)+2NO(g)?N2(g)+CO2(g)△H,某研究小组向某密闭容器内加入一定量的活性碳和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度下:
①T3℃时,该反应的平衡常数K=0.56(保留两位小数).
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减少CO2浓度.
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“<”或“=”).
(1)利用甲烷催化还原氮氧化物.已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
则CH4将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol.
(2)利用NH3催化还原氮氧化物的技术叫SCR技术,该技术是目前应用最广泛的烟气氮氧化物脱除技术.反应的化学方程式为2NH3(g)+NO(g)+NO2(g)$\frac{\underline{\;催化剂\;}}{\;}$2N2(g)+3H2O(g)△H<0.为提高氮氧化物的转化率可采取的措施是增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等(写出一条即可).
(3)利用ClO2氧化氮氧化物,其转化流程如下:NO$→_{反应Ⅰ}^{ClO_{2}}$NO2$→_{反应Ⅱ}^{Na2SO3}$N2.已知反应Ⅰ的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,则反应Ⅱ的化学方程式是2NO2+4Na2SO3═N2+4Na2SO4;若生成11.2LN2(标准状况),则消耗ClO267.5g.
(4)用活性碳还原法处理氮氧化物,有关反应为C(s)+2NO(g)?N2(g)+CO2(g)△H,某研究小组向某密闭容器内加入一定量的活性碳和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度下:
| 浓度/mol.L-1 | NO | N2 | CO2 |
| 时间/min | |||
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.30 | 0.030 |
| 30 | 0.040 | 0.30 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减少CO2浓度.
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“<”或“=”).