题目内容
8.下列说法正确的是( )| A. | 按系统命名法,化合物 的名称为2-甲基-2-乙基丙烷 的名称为2-甲基-2-乙基丙烷 | |
| B. | 分别向皂化反应完成后的溶液、豆浆、牛奶中加入浓食盐水都有固体析出 | |
| C. | 碳原子数小于5的烷烃共有4种,他们之间互为同系物 | |
| D. | 石油裂解可以得到乙烯,煤干馏得到的煤焦油中可以提取苯,乙烯和苯使溴水褪色的原理相同 |
分析 A、烷烃命名中2号碳出现乙基,说明选取的不是最长碳链;
B、盐析一般是指溶液中加入无机盐类而使某种物质溶解度降低而析出的过程,胶体中加入食盐水发生聚沉;
C、碳原子数小于5的烷烃中,丁烷的两种互为同分异构体;
D、乙烯与溴水发生加成反应使其褪色,苯萃取溴水中的溴使其褪色.
解答 解:A、烷烃命名中2号碳出现乙基,说明选取的不是最长碳链, 最长碳链为5,正确命名应为2,2-二甲基丁烷,故A错误;
最长碳链为5,正确命名应为2,2-二甲基丁烷,故A错误;
B、加入食盐可以使高级脂肪酸钠从混合物中析出,这一过程叫盐析,豆浆、牛奶中加入浓食盐水都有固体析出,此为胶体的聚沉,三者均有沉淀形成,故B正确;
C、碳原子数小于5的烷烃有5种,分别是甲烷、乙烷、丙烷、正丁烷和异丁烷,其中正丁烷和异丁烷分子式相同,结构不同,互为同分异构体,故C错误;
D、乙烯与溴水发生加成反应使其褪色,苯萃取溴水中的溴使其褪色,两者原理不相同,故D错误,
故选B.
点评 本题主要考查的是烷烃的命名、胶体的性质、同分异构体与同系物的区别,乙烯与苯的性质等,综合性较强,但是难度不大,

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示.
请回答:
(l)d属于d区的元素,其基态原子的价电子排布图为 .
.
(2)b与其同周期相邻元素第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)c的氢化物水溶液中存在的氢键有4种,任意画出一种 、
、 、
、 、
、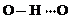 任意一种.
任意一种.
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为SiO2>CO2(用化学式表示).若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为平面三角形;A的中心原子的轨道杂化类型为sp3杂化;与A互为等电子体的一种分子为SO3(填化学式).
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的 晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为H4Cu3Au,若该晶体的相对分子质量为M,密度为ag/cm3,则晶胞的体积为$\frac{M}{a{N}_{A}}$ cm3(NA用表示阿
伏加德罗常数的值).
| a | 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| b | 基态原子的p轨道电子数比s轨道电子数少1 |
| c | 在周期表所列元素中电负性最大 |
| d | 位于周期表中第4纵行 |
| e | 基态原子M层全充满,N层只有一个电子 |
(l)d属于d区的元素,其基态原子的价电子排布图为
 .
.(2)b与其同周期相邻元素第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)c的氢化物水溶液中存在的氢键有4种,任意画出一种
 、
、 、
、 、
、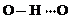 任意一种.
任意一种.(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为SiO2>CO2(用化学式表示).若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为平面三角形;A的中心原子的轨道杂化类型为sp3杂化;与A互为等电子体的一种分子为SO3(填化学式).
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的 晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为H4Cu3Au,若该晶体的相对分子质量为M,密度为ag/cm3,则晶胞的体积为$\frac{M}{a{N}_{A}}$ cm3(NA用表示阿
伏加德罗常数的值).
19.H、C、N、O、Al、Fe是六种常见元素
(1)Fe位于周期表第四周期,第VIII族,其基态原子未成对电子数为4.碳的同素异形体中,金刚石熔点比C60高(填“高”、“低”).
(2)用“>”或“<”填空:
(3)Al能将污水中NO3-转化为N2,同时铝的反应产物还能净化污水,该反应的离子方程式10Al+6NO3-+18H2O=3N2↑+10Al(OH)3+6OH-;其中产生的铝的化合物能净水的原理是生成的Al(OH)3胶体具有吸附作用.
(4)已知2H2(g)+O2(g)=2H2O(l)△H=-571.66kJ•mol-1
CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1306.42kJ•mol-1
写出利用CO2和H2合成(CH2=CH2)的热化学方程式为2CO2(g)+6H2(g)═CH2=CH2(g)+4H2O(l)△H=-408.56kJ•mol-1.
(1)Fe位于周期表第四周期,第VIII族,其基态原子未成对电子数为4.碳的同素异形体中,金刚石熔点比C60高(填“高”、“低”).
(2)用“>”或“<”填空:
| 离子半径 | 电负性 | 第一电离能 | 沸点 |
| O2->Al3+ | C<N | N>O | CH4< NH3 |
(4)已知2H2(g)+O2(g)=2H2O(l)△H=-571.66kJ•mol-1
CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1306.42kJ•mol-1
写出利用CO2和H2合成(CH2=CH2)的热化学方程式为2CO2(g)+6H2(g)═CH2=CH2(g)+4H2O(l)△H=-408.56kJ•mol-1.
16.中国环境监测总站数据显示,PM2.5、SO2、NOx等是连续雾霾过程影响空气质量显著的污染物,其主要来源为燃煤、机动车尾气等.因此,对它们进行研究具有重要意义.请回答:
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据计算PM2.5待测试样的pH=4.
(2)NOx是汽车尾气的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:
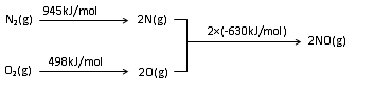
N2(g)+O2(g)?2NO (g)△H=+183kJ/mol.
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度(mol/L) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)NOx是汽车尾气的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:

N2(g)+O2(g)?2NO (g)△H=+183kJ/mol.
3.电解NO制备NH4NO3,其工作原理如图所示,下列说法不正确的是( )
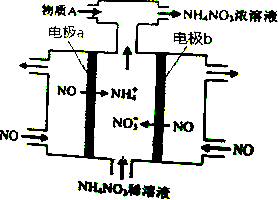

| A. | b极的电极反应为:NO-3e-+4OH-=NO${\;}_{3}^{-}$+2H2O | |
| B. | 溶液中的H+由电极b处向电极a处迁移 | |
| C. | 电解过程总反应的化学方程式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3 | |
| D. | 为使电解产物全部转化为NH4NO3,需补充的物质A是NH3 |
13.下列根据实验操作和实验现象所得出的结论,正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向2mL 2%CuSO4溶液中加入0.5mL 1%的NaOH溶液,振荡后滴加M溶液,加热 | 未出现砖红色沉淀 | M中不含醛基 |
| B | 在CuSO4溶液中介入KI溶液,再加入苯,振荡后静置 | 有白色沉淀生成,苯层呈紫红色 | 白色沉淀可能为CuI |
| C | 向有机试剂N中加入2mL5%的NaOH溶液,加热,冷却后取上层溶液滴加几滴AgNO3溶液 | 出现褐色沉淀 | N不是卤代烃 |
| D | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液 | 溶液变为血红色 | Fe(NO3)2已氧化变质 |
18.如图是某分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.该分子是( )
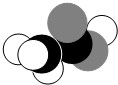

| A. | C2H5OH | B. | CH3COOH | C. | CH3CHO | D. | HCOOCH3 |
19.某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250mL 0.2mol/L的醋酸溶液,用0.2mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对稀释后醋酸溶液的浓度进行标定.回答下列问题:
(1)配制250mL 0.2mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为标定某醋酸溶液的准确浓度,用0.2000mol/L的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
则该醋酸溶液的准确浓度为0.2000mol/L(保留小数点后四位).
实验二:探究浓度对醋酸电离程度的影响
用pH计测定25°C时不同浓度的醋酸的pH,结果如下:
回答下列问题:
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是0.010 0 mol/L 醋酸的pH大于2
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度增大(填“增大”、“减小”或“不变”).
(5)实验三:该同学用pH计测定相同浓度的醋酸在几种不同温度时的pH,该同学的实验目的是:用pH计测定相同浓度的醋酸在几种不同温度时的pH.
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250mL 0.2mol/L的醋酸溶液,用0.2mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对稀释后醋酸溶液的浓度进行标定.回答下列问题:
(1)配制250mL 0.2mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为标定某醋酸溶液的准确浓度,用0.2000mol/L的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶 液的体积(mL) | 20.05 | 20.00 | 18.50 | 19.95 |
实验二:探究浓度对醋酸电离程度的影响
用pH计测定25°C时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度 (mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是0.010 0 mol/L 醋酸的pH大于2
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度增大(填“增大”、“减小”或“不变”).
(5)实验三:该同学用pH计测定相同浓度的醋酸在几种不同温度时的pH,该同学的实验目的是:用pH计测定相同浓度的醋酸在几种不同温度时的pH.