题目内容
【题目】下列图示与对应的叙述不相符的是
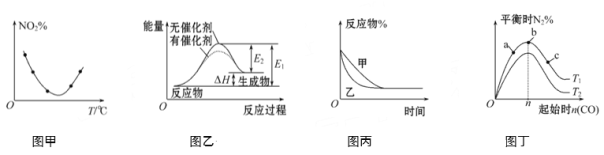
A. 图甲表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)![]() N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH<0
B. 图乙表示的反应是吸热反应,该图表明催化剂不能改变化学反应的焓变
C. 图丙表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(g)的影响,则P乙>P甲
3C(g)+D(g)的影响,则P乙>P甲
D. 图丁表示反应:4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,平衡常数K1>K2
N2(g)+4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,平衡常数K1>K2
【答案】D
【解析】
A.因图甲表示等量NO2在容积相同时不同温度下,相同时间后测得的NO2含量的曲线,开始一段时间NO2的含量随温度的升高而减小,这是因为温度升高反应速率加快,反应正向进行的程度逐渐增大,当NO2含量达到最小值(即曲线的最低点)时该反应达到平衡状态,据图像知,继续升高温度NO2含量又逐渐增大,说明升高温度平衡向逆反应方向进行,根据勒夏特列原理,该反应的逆反应是吸热反应,所以该反应(即正反应)是放热反应即ΔH<0,图示与对应的叙述相符,A项错误;
B.由图像可知,该反应的反应物总能量小于生成物总能量,因此该反应是吸热反应。根据图像可知,使用催化剂可以降低正反应的活化能(E1)和逆反应的活化能(E2),但反应物总能量与生成物总能量没有改变,即不能改变反应热,恒下的反应热等于焓变,图示与对应的叙述相符,B项错误;
C.因为图丙表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(g)的影响,曲线乙反应达到平衡所用时间比曲线甲达到平衡所用时间短,对于气体反应压强越大反应速率越快,因此乙反应的压强大于甲反应的压强,图示与对应的叙述相符,C项错误;
3C(g)+D(g)的影响,曲线乙反应达到平衡所用时间比曲线甲达到平衡所用时间短,对于气体反应压强越大反应速率越快,因此乙反应的压强大于甲反应的压强,图示与对应的叙述相符,C项错误;
D.一方面,当温度相同时,开始一段时间随着CO的物质的量[n(CO)]的逐渐增大,平衡向正反应方向移动,平衡时N2%(N2在反应混合气体中的含量)逐渐增大;继续增大CO的物质的量,容器中气体总物质的量的增加超过了因平衡移动时N2物质的量的增加,故后来N2%随CO的物质的量增加而减小。另一方面,当n(CO)相同温度由T1变为T2时,平衡时N2%减小,说明平衡向逆反应方向移动,因此T1的平衡常数大于T2的平衡常数,即K1>K2。根据4CO(g)+2NO2(g)![]() N2(g)+4CO2(g); ΔH<0可知,只有升温该反应的平衡常数才减小,所以T1<T2,图示与对应的叙述不相符,D项正确;答案选D。
N2(g)+4CO2(g); ΔH<0可知,只有升温该反应的平衡常数才减小,所以T1<T2,图示与对应的叙述不相符,D项正确;答案选D。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(原理)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol·L-1 H2C2O4溶液 | H2O | 0.2mol·L-1 KMnO4溶液 | 3mol·L-1稀硫酸 | ||
1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6. 4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是____________________;
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:v(KMnO4)= __________;
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
|
|
图1 | 图2 |
①该小组同学提出的假设是__________________________________________;
②请你帮助该小组同学完成实验方案,并填完表中空白。
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | ||||
0.6mol·L-1 H2C2O4溶液 | H2O | 0.2mol·L-1 KMnO4溶液 | 3mol·L-1稀硫酸 | 向试管中加入少量固体 | ||
4 | 3.0 | 2.0 | 3.0 | 2.0 | _____________ | t |
③若该小组同学提出的假设成立,应观察到的现象是______________________。
【题目】近年来,雾霾天气多次肆虐全国各地。其中,燃煤的烟道气和汽车尾气中含有的氮氧化合物是造成空气污染的原因之一。
(1)用CH4催化还原氮氧化物。已知CH4 (g)+2O2 (g)=CO2 (g)+2H2O (l);ΔH1=a kJ/mol,欲计算反应CH4 (g)+4NO (g)=2N2 (g)+CO2 (g)+2H2O (l)的焓变ΔH2 , 则还需要查找某化合反应的焓变ΔH3,当反应中各物质化学计量数之比为最简整数比时 ΔH3 = b kJ/mol,则该反应的热化学方程式为____________________。据此计算出ΔH2 =_______kJ/mol(用含a和b的式子表示)。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s) + 2NO(g)![]() N2 (g) + CO2 (g) ΔH。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g) + CO2 (g) ΔH。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
① T1℃时,该反应的平衡常数K=___________(保留两位小数)。
② 30 min后,改变某一条件,反应重新达到平衡,则改变的条件可能是________________。
③ 若30 min后升高温度至T2℃/span>,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的ΔH____________0(填“>”、“=”或“<”)。