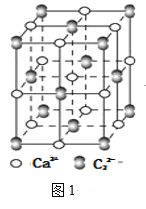
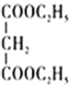题目内容
【题目】20℃时,用0.1mol/L盐酸滴定20mL0.1mol/L氨水的图像如图所示,下列说法正确的是( )

A.a点时c(Cl-)=2c(NH3H2O)+2c(NH![]() )
)
B.b点表示酸碱恰好完全反应
C.c点时c(NH![]() )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)
D.a、b、c、d均有c(NH![]() )+c(H+)=c(Cl-)+c(OH-)
)+c(H+)=c(Cl-)+c(OH-)
【答案】D
【解析】
A.a点时加入的盐酸为10mL,所得溶液的溶质为等物质的量浓度的氯化铵和一水合氨,根据物料守恒2c(Cl-)=c(NH3H2O)+c(NH![]() ),故A错误;
),故A错误;
B.c点时加入的盐酸为20mL,表示酸碱恰好完全反应,b点表示碱过量,盐酸完全反应,故B错误;
C.c点时,酸碱恰好完全反应生成氯化铵,溶液显酸性,c(H+)>c(OH-),根据电荷守恒:c(NH![]() ) + c(H+) = c(Cl-)+c(OH-)可知,c(NH
) + c(H+) = c(Cl-)+c(OH-)可知,c(NH![]() )<c(Cl-),故C错误;
)<c(Cl-),故C错误;
D.a、b、c、d对应的溶液中均只有NH![]() 、H+、Cl-和OH-四种离子,根据电荷守恒,故都有c(NH
、H+、Cl-和OH-四种离子,根据电荷守恒,故都有c(NH![]() )+c(H+)=c(Cl-)+c(OH-),故D正确;
)+c(H+)=c(Cl-)+c(OH-),故D正确;
故答案为:D。

【题目】某学生探究如下实验(A):
实验A | 条件 | 现象 |
| 加热 | i.加热后蓝色褪去 ii.冷却过程中,溶液恢复蓝色 ⅲ.一段时间后,蓝色重又褪去 |
(1)使淀粉变蓝的物质是____。
(2)分析现象i、ii认为:在酸性条件下,加热促进淀粉水解,冷却后平衡逆向移动。
设计实验如下,“现象a”证实该分析不合理:

“现象a”是____。
(3)再次分析:加热后单质碘发生了变化,实验如下:
I:取少量碘水,加热至褪色,用淀粉溶液检验挥发出的物质,变蓝。
Ⅱ:向褪色后的溶液中滴加淀粉溶液,冷却过程中一直未变蓝;加入稀H2SO4,瞬间变蓝。
对步骤Ⅱ中稀H2SO4的作用,结合离子方程式,提出一种合理的解释:______________。
(4)探究碘水褪色后溶液的成分:
实验1:测得溶液的pH≈5
实验2:取褪色后的溶液,完成如下实验:

①产生黄色沉淀的离子方程式是____。
②Ag2O的作用是____________。
③依据上述实验,推测滤液中含有的物质(或离子)可能是_________。
(5)结合化学反应速率解释实验A中现象i、现象iii蓝色褪去的原因:_______________。
【题目】氢气是一种清洁能源。制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题。(1)用甲烷制取氢气的两步反应的能量变化如下图所示:
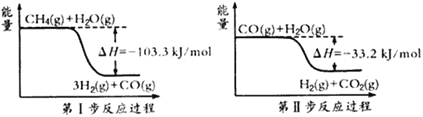
①甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是________________。
②第Ⅱ步反应为可逆反应。800℃时,若CO的起始浓度为2.0 mol·L-1,水蒸气的起始浓度为3.0 mol·L-1,达到化学平衡状态后,测得CO2的浓度为1.2 mol·L-1,则CO的平衡转化率为__________。
(2)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B元素的化合价不变,该反应的化学方程式为___________________,反应消耗1mol NaBH4时转移的电子数目为_______。
(3)储氢还可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢。
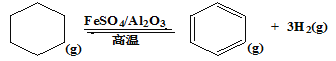
在某温度下,向恒容容器中加入环已烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=____________________(用含a、b的关系式表达)。
(4)一定条件下,如下图所示装置可实现有机物的电化学储氢(除目标产物外,近似认为无其它有机物生成)。
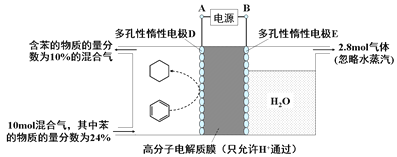
①实现有机物储氢的电极是________;
A.正极 | B.负极 | C.阴极 | D.阳极 |
其电极反应方程为:________________________。
②该储氢装置的电流效率η明显小于100%,其主要原因是相关电极除目标产物外,还有一种单质气体生成,这种气体是_________。由表中数据可知,此装置的电流效率η=______________。[η=(生成目标产物消耗的电子数/转移的电子总数)×100%,计算结果保留小数点后1位]。