题目内容
【题目】元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。
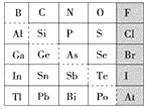
(1)元素Ga在元素周期表中的位置为:第_____周期第____族。
(2)Sn的最高正价为____,Cl的最高价氧化物对应水化物的化学式为___,Bi的最高价氧化物为_____。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是______元素(填元素符号)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4______H2SeO4(填“>”“<”或“=”)。
③氢化物的还原性:H2O______H2S(填“>”“<”或“=”)。
④原子半径比较:N______Si(填“>”“<”或“=”)。
(4)可在图中分界线(虚线部分)附近寻找______(填序号)。
A.优良的催化剂 B.半导体材料C.合金材料 D.农药
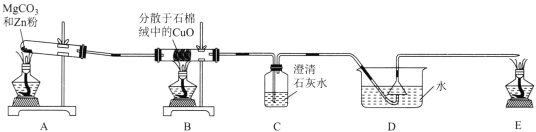
(5)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)________。
![]()
【答案】四 (2) ⅢA +4 HClO4 Bi2O5 F < < < B 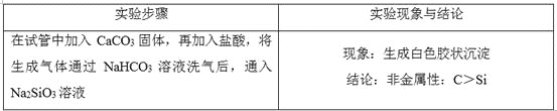
【解析】
(1)根据Ga和Al同主族,在Al的下一个周期来回答判断;
(2)根据同主族元素性质递变规律来回答;
(3)同主族元素从上到下,氢化物稳定性减弱,原子半径逐渐增大,最高价含氧酸的酸性减弱,同周期元素从右到左,氢化物稳定性减弱,原子半径逐渐增大,最高价含氧酸的酸性减弱,据此回答;
(4)金属和非金属的分界线附近来寻找半导体材料;
(5)根据元素的最高价含氧酸的酸性越强,则元素的非金属性越强来回答。
(1)Ga和Al同主族,在Al的下一个周期,即第四周期第ⅢA族;
(2)Sn和碳同主族,最高价是+4价;Cl的最高价是+7价,最高价氧化物对应水化物的化学式为HClO4;Bi和N元素同主族,所以最高正价是+5价,最高价氧化物为:Bi2O5;
(3)①同主族元素从上到下,氢化物稳定性减弱,同周期元素从右到左,氢化物稳定性减弱,所以阴影部分元素氢化物热稳定性最高的是F;
②As和Se同一周期,同周期元素从右到左,最高价含氧酸的酸性减弱,所以H3AsO4、H2SeO4的酸性强弱:H3AsO4<H2SeO4;
③原子半径:氧原子大于硫原子,非金属性减弱,氢化物的还原性:H2O<H2S;
④原子电子层越多,半径越大,所以原子半径:N<Si;
(4)可在金属和非金属的分界线附近来寻找半导体材料;
(5)C、Si的非金属性强弱顺序为C>Si,可以根据碳酸酸性强于硅酸来证明,化学反应中,强酸可以制得弱酸,即在试管中加入CaCO3固体,再加入盐酸,将生成气体通过NaHCO3溶液洗气后,通入Na2SiO3溶液中生成白色胶状沉淀,则碳酸酸性强于硅酸,结论:非金属性:C>Si。

 科学实验活动册系列答案
科学实验活动册系列答案