题目内容
【题目】铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
反应 | △H(kJ/mol) | K |
i. Fe2O3(s)+3C(s) | +489 | K1 |
ii. Fe2O3(s)+3CO(g) | X | K2 |
iii. C(s)+CO2(g) | +172 | K3 |
试计算,X=_____,K1、K2与K3之间的关系为____________。
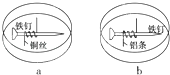
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_____(填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度
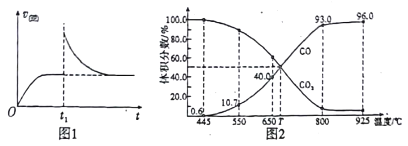
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2 与足量的碳,发生反应ⅲ,平衡时体系中气体体积分数与温度的关系如图2 所示。
①650℃时,该反应达平衡后吸收的热量是______。(计算时不考虑温度对△H的影响)
②T℃时,若向平衡体系中再充入一定量按V(CO2):V(CO) =5:4的混合气体,平衡_____(填“ 正向”、“ 逆向”或“ 不” )移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____。[气体分压(p分)=气体总压(p总) ×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如图3所示( 导电壳内部为纳米零价铁)。
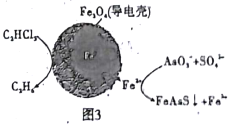
在除污过程中,纳米零价铁中的Fe为原电池的______极 (填“正"或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为_____________。
【答案】 -27 K3=![]() ad 43kJ 正向 23.04P总 负 C2HCl3 +5H++8e-=C2H6 +3C1-
ad 43kJ 正向 23.04P总 负 C2HCl3 +5H++8e-=C2H6 +3C1-
【解析】(1). 已知 ① Fe2O3(s)+3C(s) ![]() 2Fe(s)+3CO(g) △H=+489kJ/mol,② C(s)+CO2(g)
2Fe(s)+3CO(g) △H=+489kJ/mol,② C(s)+CO2(g) ![]() 2CO(g) △H=+172kJ/mol,根据盖斯定律可知,①-②×3得Fe2O3(s)+3CO(g)
2CO(g) △H=+172kJ/mol,根据盖斯定律可知,①-②×3得Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) △H=-27kJ/mol,由上述计算过程可知:K3=
2Fe(s)+3CO2(g) △H=-27kJ/mol,由上述计算过程可知:K3=![]() ,故答案为:-27;K3=
,故答案为:-27;K3=![]() ;
;
(2). T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应Fe2O3(s)+3C(s) ![]() 2Fe(s)+3CO(g),反应达到平衡后,在t1时刻,改变某条件,V(逆)突然增大,但重新达到平衡后与原平衡相同,说明温度不变,平衡常数K=c(CO)不变,则t1时刻改变的条件可以是压缩容器的体积或增大CO的浓度,故答案为:ad;
2Fe(s)+3CO(g),反应达到平衡后,在t1时刻,改变某条件,V(逆)突然增大,但重新达到平衡后与原平衡相同,说明温度不变,平衡常数K=c(CO)不变,则t1时刻改变的条件可以是压缩容器的体积或增大CO的浓度,故答案为:ad;
(3). ①. 由图2可知,650℃时,反应达到平衡后,CO的体积分数为40%,根据化学平衡“三段式”法有:
C(s)+CO2(g) ![]() 2CO(g)
2CO(g)
起始(mol) 1 0
转化(mol) x 2x
平衡(mol) 1-x 2x
则![]() ×100%=40%,解得x=0.25mol,由C(s)+CO2(g)
×100%=40%,解得x=0.25mol,由C(s)+CO2(g) ![]() 2CO(g) △H=+172kJ/mol可知,该反应达平衡后吸收的热量是:0.25mol×172kJ/mol=43kJ,故答案为:43kJ;
2CO(g) △H=+172kJ/mol可知,该反应达平衡后吸收的热量是:0.25mol×172kJ/mol=43kJ,故答案为:43kJ;
②. T℃时,若向平衡体系中再充入一定量按V(CO2):V(CO)=5:4的混合气体,因原平衡时V(CO2):V(CO)=1:1,则V(CO2):V(CO)=5:4大于原平衡状态下的V(CO2):V(CO)=1:1,平衡正向移动,故答案为:正向;
③. 925℃时,CO的体积分数为96%,则CO2的体积分数为4%,所以用平衡分压代替平衡浓度表示的化学平衡常数Kp=![]() =23.04P总,故答案为:23.04P总;
=23.04P总,故答案为:23.04P总;
(4). 由图3可知,纳米零价铁中Fe失电子作负极,C2HCl3在其表面被还原为乙烷,根据电荷守恒和原子守恒,该电极反应式为:C2HCl3+5H++8e-=C2H6+3C1-,故答案为:负;C2HCl3+5H++8e-=C2H6+3C1-。

【题目】下表中物质的分类组合正确的是( )
选项 | A | B | C | D |
强电解质 | Al2(SO4)3 | BaSO4 | HF | KClO3 |
弱电解质 | H3PO4 | H2O | CaCO3 | Al(OH)3 |
非电解质 | CO2 | NH3·H2O | NH3 | HI |
A. A B. B C. C D. D
【题目】元素周期表与元素周期律在学习、研究和生产实践中有重要的作用。下表列出①~⑩十种元素在周期表中的位置。请用化学用语回答下列问题:
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑧ | ||||||
3 | ① | ③ | ④ | ⑦ | ⑨ | |||
4 | ② | ⑥ | ⑩ |
(1)②的元素符号是________。
(2)在①、②、③三种元素中,原子半径由大到小的顺序依次是________。
(3)①、⑧二种元素形成的化合物,在高温下灼烧,火焰呈________。
(4)⑦、⑨二种元素的最高价氧化物对应水化物的酸性较强的是________,用原子结构理论解释:________。
(5)⑤元素的氢化物实验室制法的化学方程式是________。此反应的能量变化示意图如右图所示,该反应是______反应(选填“放热”或“吸热”),判断依据是______。

(6)对⑥元素的说法正确的是________(填字母)。
a. ⑥的非金属性强于⑤
b. 氢化物稳定性:⑥<⑩
c. 最高价氧化物对应水化物的酸性:⑥<⑤