题目内容
9.下列污水处理的方法、目的和离子方程式及其对应关系均正确的是( )| 方法 | 目的 | 离子方程式 | |
| A | 中和法 | 用H2SO4中和碱性废水 | H++OH-═H2O |
| B | 混凝法 | 除去水中悬浮物 | Al3++H2O═Al(OH)3↓+H+ |
| C | 沉淀法 | 除去废水中的Hg2+ | Hg2++Na2S═HgS↓+Na+ |
| D | 氧化法 | 消毒 | Cl2+2OH-═Cl-+ClO-+H2O |
| A. | A | B. | B | C. | C | D. | D |
分析 A.硫酸能够中和废水中的氢氧根离子;
B.铝离子水解生成的氢氧化铝为胶体,不是氢氧化铝沉淀;
C.硫化钠为强电解质,离子方程式中应该拆开;
D.氧化法是利用氯气与水反应生成氯化氢和次氯酸,不是中和氢氧根离子.
解答 解:A.废水中含有大量氢氧根离子时,可用H2SO4中和碱性废水,反应的离子方程式为:H++OH-═H2O,故A正确;
B.除去水中悬浮物,可向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O?Al(OH)3(胶体)+3H+,故B错误;
C.用Na2S去除废水中的Hg2+,硫化钠需要拆开,正确的离子方程式为Hg2++S2-=HgS↓,故C错误;
D.氧化法处理污水,利用的是氯气与水反应生成的次氯酸,正确的反应为:Cl2+H2O═Cl-+HClO+H+,故D错误;
故选A.
点评 本题考查了离子方程式书写、污水的处理方法判断,题目难度中等,注意掌握离子方程式的书写原则,明确常见污水处理方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.在醋酸与氢氧化钠溶液的反应过程中,溶液中的相关离子浓度呈现出下列排列顺序:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).满足该条件的反应可能是( )
| A. | pH=2的CH3COOH与pH=12的NaOH溶液等体积混合 | |
| B. | 0.1 mol/L的CH3COOH溶液与0.2 mol/L的NaOH溶液等体积混合 | |
| C. | CH3COOH与NaOH溶液混合后所得溶液的pH=7 | |
| D. | 0.1 mol/L的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合 |
4.下列环境问题与所对应的物质不相关的是( )
| A. | 温室效应--二氧化碳 | B. | 酸雨--二氧化碳 | ||
| C. | 白色污染--废塑料制品 | D. | 臭氧层破坏--氟氯代烷 |
14.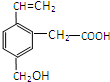 某有机物的结构如图所示,这种有机物不可能具有的性质是
某有机物的结构如图所示,这种有机物不可能具有的性质是
①能使酸性KMnO4溶液褪色;②可以燃烧;
③能发生水解反应;④能发生酯化反应;
⑤能发生加聚反应;⑥能跟NaOH溶液反应( )
 某有机物的结构如图所示,这种有机物不可能具有的性质是
某有机物的结构如图所示,这种有机物不可能具有的性质是①能使酸性KMnO4溶液褪色;②可以燃烧;
③能发生水解反应;④能发生酯化反应;
⑤能发生加聚反应;⑥能跟NaOH溶液反应( )
| A. | ①④ | B. | 只有⑥ | C. | 只有③ | D. | ④⑥ |
1.如图为元素周期表前四周期的一部分,且 X、Y、Z、R 和 W 为主族元素.下列说法正确的是( )
| X | |||
| Y | Z | R | |
| W |
| A. | 五种元素的原子最外层电子数一定都大于 2 | |
| B. | Y 单质一定既能与盐酸又能与氢氧化钠溶液反应 | |
| C. | R 的最高价氧化物对应的水化物一定是强酸 | |
| D. | 若 Z 位于第ⅣA 族,则 Z 的氧化物与 Y 的氧化物中化学键类型相同 |
19.质量相等的下列物质中,含氧原子数最多的是( )
| A. | H2O | B. | CO2 | C. | H2SO4 | D. | H3PO4 |
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题: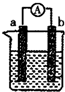 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置. (1)18电子分子中含有4个原子,其结构式是H-O-O-H或PH3
(1)18电子分子中含有4个原子,其结构式是H-O-O-H或PH3