题目内容
10.A、B、C、D、E、F、G为6种短周期主族元素,其原子序数依次增大.A、C可形成A2C和A2C2两种共价化合物,B的最高正化合价与最低负化合价的绝对值之差为2,D和A同主族,E是地壳中含量最高的金属元素,F和C同主族且可形成FC2和FC3两种化合物.(1)G的元素名称氯,在元素周期表中的位置是第三周期VIIA族.
(2)下列说法正确的是bd(填序号).
a.FC2具有漂白性,是因其具有强氧化性
b.A2C和A2C2分子中所含的化学键类型不完全相同
c.B的氢化物与G的氢化物相遇观察不到明显的现象
d.将E的单质放入F的最高价氧化物对应水化物的浓溶液中可能观察不到明显现象
(3)工业上冶炼E的单质反应的化学方程式是2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
(4)由上述6种元素中的4种元素组成化合物X,X既能与热的NaOH溶液反应,也能与稀盐酸反应,且均能生成无色气体.
①X的化学式是(NH4)2 SO3或NH4HSO3.
②X的溶液与稀盐酸反应的离子方程式是SO32-+2H+=SO2↑+H2O或HSO3-+H+=SO2↑+H2O.
分析 A、B、C、D、E、F、G为7种短周期主族元素,其原子序数依次增大.A、C可形成A2C和A2C2两种共价化合物,则A为H元素、C为O元素;D和A同主族,D的原子序数大于氧,故D为Na;B的最高正化合价与最低负化合价的绝对值之差为2,最外层电子数为5,原子序数小于氧,故B为N元素;E是地壳中含量最高的金属元素,则E为Al;F和C同主族且可形成FC2和FC3两种化合物,则F为S元素,G的原子序数最大,故G为Cl,据此解答.
解答 解:A、B、C、D、E、F、G为7种短周期主族元素,其原子序数依次增大.A、C可形成A2C和A2C2两种共价化合物,则A为H元素、C为O元素;D和A同主族,D的原子序数大于氧,故D为Na;B的最高正化合价与最低负化合价的绝对值之差为2,最外层电子数为5,原子序数小于氧,故B为N元素;E是地壳中含量最高的金属元素,则E为Al;F和C同主族且可形成FC2和FC3两种化合物,则F为S元素,G的原子序数最大,故G为Cl.
(1)G的元素名称为:氯,在元素周期表中的位置是:第三周期VIIA族,故答案为:氯;第三周期VIIA族;
(2)a.SO2具有漂白性,是因其与有色物质化合为不稳定的无色物质,故a错误;
b.H2O含有极性键,H2O2分子含有极性键与非极性键,所含的化学键类型不完全相同,故b正确;
c.B的氢化物为NH3,G的氢化物为HCl,二者相遇生成氯化铵,由白烟产生,故c错误;
d.F的最高价氧化物对应水化物为硫酸.将Al放入浓硫酸中发生钝化选项,可能观察不到明显现象,故d正确,
故选:bd;
(3)工业上冶炼Al的单质反应的化学方程式是:2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,
故答案为:2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;
(4)由上述7种元素中的4种元素组成化合物X,X既能与热的NaOH溶液反应,也能与稀盐酸反应,且均能生成无色气体,则X为(NH4)2 SO3或NH4HSO3,与稀盐酸反应的离子方程式是:SO32-+2H+=SO2↑+H2O或HSO3-+H+=SO2↑+H2O,
故答案为:(NH4)2 SO3或NH4HSO3;SO32-+2H+=SO2↑+H2O或HSO3-+H+=SO2↑+H2O.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对基础知识的理解掌握.

| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| A. | 纯碱 | B. | 小苏打 | C. | 干冰 | D. | 尿素 |
| A. | 电解饱和食盐水制备金属钠 | B. | 加热分解Ag2O制备金属银 | ||
| C. | Fe2O3与CO高温下反应制备金属铁 | D. | Cu2S与O2高温下反应制备金属铜 |
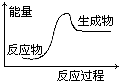
| A. | 酸与碱的中和反应 | B. | 镁和盐酸的反应 | ||
| C. | 氧化钙和水反应 | D. | 水发生分解反应 |
| A. | CH4 | B. | C2 H4 | C. | C2H2 | D. | S02 |
| A. | pH=2的CH3COOH与pH=12的NaOH溶液等体积混合 | |
| B. | 0.1 mol/L的CH3COOH溶液与0.2 mol/L的NaOH溶液等体积混合 | |
| C. | CH3COOH与NaOH溶液混合后所得溶液的pH=7 | |
| D. | 0.1 mol/L的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合 |


 ;
; ;
; .
. 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题: