题目内容
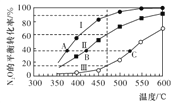
【题目】在四个恒容密闭容器中按左下表相应量充入气体,发生反应2N2O(g)![]() 2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如下图所示:
2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如下图所示:
容器 | 容积/L | 起始物质的量/mol | ||
N2O | N2 | O2 | ||
Ⅰ | V1 | 0.1 | 0 | 0 |
Ⅱ | 1.0 | 0.1 | 0 | 0 |
Ⅲ | V3 | 0.1 | 0 | 0 |
Ⅳ | 1.0 | 0.06 | 0.06 | 0.04 |
下列说法正确的是
A. 该反应的正反应放热
B. 相同温度下反应相同时间,平均反应速率:v(Ⅰ)>v(Ⅱ)
C. 容器Ⅳ在470℃进行反应时,起始反应速率:v正(N2O)<v逆(N2O)
D. 图中A、B、C三点处容器内总压强:pA(I)< pB(Ⅱ)<pC(Ⅲ)
【答案】D
【解析】A项,由图可得,温度升高N2O的平衡转化率增大,所以温度升高促进化学平衡正向移动,该反应的正反应吸热,故A错误;B项,容器Ⅰ和Ⅱ中N2O的起始物质的量相等,因为该反应正向气体分子数增大,所以压强越小N2O的平衡转化率越大,由图可得,相同温度下N2O的平衡转化率Ⅰ大于Ⅱ,因此压强Ⅰ小于Ⅱ,所以相同温度下反应相同时间,平均反应速率:v(Ⅰ)<v(Ⅱ),故B错误;由图可得,容器Ⅱ在470℃进行反应时N2O的平衡转化率为60%,则平衡时c(N2O)=0.04mol/L、c(N2)=0.06mol/L、c(O2)=0.03mol/L,所以K=![]() =
=![]() =0.0675,由表中数据可得,容器Ⅳ在470℃进行反应时,Q=
=0.0675,由表中数据可得,容器Ⅳ在470℃进行反应时,Q=![]() =0.04,所以Q<K,平衡正向移动,v正(N2O)>v逆(N2O),故C错误;D项,容器Ⅰ、Ⅱ、Ⅲ中N2O的起始物质的量相等,因为该反应正向气体分子数增大,所以压强越小N2O的平衡转化率越大,由图可得,相同温度下N2O的平衡转化率:Ⅰ>Ⅱ>Ⅲ,因此反应开始时压强:Ⅰ<Ⅱ<Ⅲ,则转化率均为40%时的A、B、C三点处容器内总压强:pA(I)< pB(Ⅱ)<pC(Ⅲ),故D正确。
=0.04,所以Q<K,平衡正向移动,v正(N2O)>v逆(N2O),故C错误;D项,容器Ⅰ、Ⅱ、Ⅲ中N2O的起始物质的量相等,因为该反应正向气体分子数增大,所以压强越小N2O的平衡转化率越大,由图可得,相同温度下N2O的平衡转化率:Ⅰ>Ⅱ>Ⅲ,因此反应开始时压强:Ⅰ<Ⅱ<Ⅲ,则转化率均为40%时的A、B、C三点处容器内总压强:pA(I)< pB(Ⅱ)<pC(Ⅲ),故D正确。

【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×1010,Ksp(BaS2O3)=4.1×105。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③___________ | ④___________,有刺激性气体产生 |
⑤静置,___________ | ⑥___________ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至____________。
②滴定:取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32
3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32![]() S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。