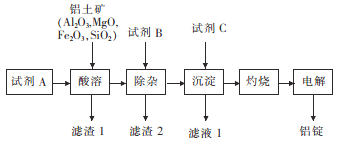
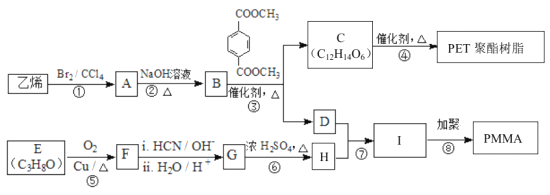
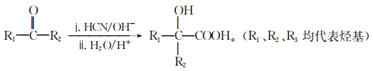题目内容
【题目】某课外活动小组探究镁与CO2、NO2的反应。
(1)实验发现点燃的镁条能在CO2气体中继续燃烧,产生黑、白两种固体,请用化学反应解释该现象_____。
(2)该小组采用类比Mg与CO2反应的思路对Mg与NO2的反应进行预测,写出Mg与NO2反应的化学方程式_____。
(3)设计实验验证猜测(用于连接玻璃管的乳胶管均内衬锡纸)。
资料信息:2NO2+2NaOH=NaNO3+NaNO2+H2O。

①装置A中的试剂是_____。
②干燥管和装置B的作用分别是_____、_____。
③实验开始时正确的操作步骤是_____。
a.通入NO2
b.打开弹簧夹
c.点燃酒精灯
d.当硬质玻璃管充满红棕色气体后,关闭弹簧夹
【答案】2Mg+CO2![]() 2MgO+C4Mg+2NO2
2MgO+C4Mg+2NO2![]() 4MgO+N2NaOH溶液吸收NO2避免污染环境收集N2badc
4MgO+N2NaOH溶液吸收NO2避免污染环境收集N2badc
【解析】
(1)点燃的镁条能在CO2气体中继续燃烧,产生黑、白两种固体为氧化镁和碳,反应的化学方程式为2Mg+CO2![]() 2MgO+C;
2MgO+C;
(2)类比Mg与CO2反应的思路,镁在二氧化氮气体中反应生成氧化镁和氮气,反应的化学方程式为4Mg+2NO2![]() 4MgO+N2;
4MgO+N2;
(3)①依据反应2NO2+2NaOH=NaNO3+NaNO2+H2O分析,装置A主要吸收多余的二氧化氮气体,需要用氢氧化钠溶液,因此装置A中的试剂是NaOH溶液;
②干燥管是在充满二氧化氮气体过程中避免污染气体排放到空气中污染空气,B装置是排水量气方法收集反应生成的氮气;
③应先在装置中充满二氧化氮气体再进行加热,防止空气的影响,所以实验顺序为badc。

【题目】在四个恒容密闭容器中按左下表相应量充入气体,发生反应2N2O(g)![]() 2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如下图所示:
2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如下图所示:
容器 | 容积/L | 起始物质的量/mol | ||
N2O | N2 | O2 | ||
Ⅰ | V1 | 0.1 | 0 | 0 |
Ⅱ | 1.0 | 0.1 | 0 | 0 |
Ⅲ | V3 | 0.1 | 0 | 0 |
Ⅳ | 1.0 | 0.06 | 0.06 | 0.04 |
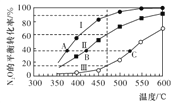
下列说法正确的是
A. 该反应的正反应放热
B. 相同温度下反应相同时间,平均反应速率:v(Ⅰ)>v(Ⅱ)
C. 容器Ⅳ在470℃进行反应时,起始反应速率:v正(N2O)<v逆(N2O)
D. 图中A、B、C三点处容器内总压强:pA(I)< pB(Ⅱ)<pC(Ⅲ)