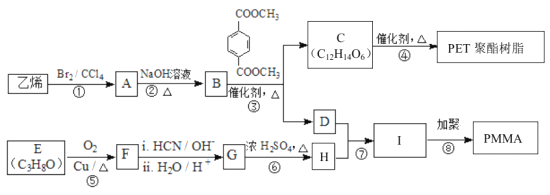
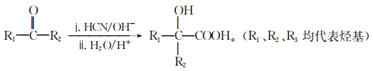题目内容
【题目】下列离子方程式不正确的是
A. 氯气溶于水:Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
B. Fe和盐酸反应:Fe+2H+ ═Fe3++H2↑
C. NO2溶于水的反应:3NO2+H2O ═ 2H+ + 2NO3- + NO
D. 氧化铜与硫酸反应:CuO+2H+═ Cu2++H2O
【答案】B
【解析】
A.氯气溶于水生成盐酸和次氯酸,离子方程式为:Cl2+H2O![]() H++Cl-+HClO,A项正确;
H++Cl-+HClO,A项正确;
B.Fe和盐酸反应生成氯化亚铁和氢气,离子方程式为:Fe+2H+ ═Fe2++H2↑,B项错误;
C.NO2溶于水生成硝酸和NO,离子方程式为:3NO2+H2O ═ 2H+ + 2NO3- + NO,C项正确;
D.氧化铜与硫酸反应生成硫酸铜和水,离子方程式为:CuO+2H+═ Cu2++H2O,D项正确,答案选B。

【题目】在四个恒容密闭容器中按左下表相应量充入气体,发生反应2N2O(g)![]() 2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如下图所示:
2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如下图所示:
容器 | 容积/L | 起始物质的量/mol | ||
N2O | N2 | O2 | ||
Ⅰ | V1 | 0.1 | 0 | 0 |
Ⅱ | 1.0 | 0.1 | 0 | 0 |
Ⅲ | V3 | 0.1 | 0 | 0 |
Ⅳ | 1.0 | 0.06 | 0.06 | 0.04 |
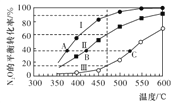
下列说法正确的是
A. 该反应的正反应放热
B. 相同温度下反应相同时间,平均反应速率:v(Ⅰ)>v(Ⅱ)
C. 容器Ⅳ在470℃进行反应时,起始反应速率:v正(N2O)<v逆(N2O)
D. 图中A、B、C三点处容器内总压强:pA(I)< pB(Ⅱ)<pC(Ⅲ)
【题目】下列物质与水反应生成强碱的是( )
A. NH3 B. Na2O C. CO2 D. NO2
【答案】B
【解析】
A. NH3溶于水生成一水合氨,属于弱碱,A错误;B. Na2O溶于水生成氢氧化钠,是强碱,B正确;C. CO2溶于水生成碳酸,属于弱酸,C错误;D. NO2溶于水生成硝酸和NO,硝酸是强酸,D错误,答案选B。
【题型】单选题
【结束】
19
【题目】利用下列装置可以完成的实验组合是
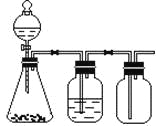
选项 | 制气装置 | 洗气瓶中试剂 | 瓶中气体 |
A | 氯酸钾 MnO2 | 浓硫酸 | O2 |
B | 石灰石 稀盐酸 | NaHCO3溶液 | CO2 |
C | Zn 稀硫酸 | 浓硫酸 | H2 |
D | MnO2 浓盐酸 | 浓硫酸 | Cl2 |
A. AB. BC. CD. D