题目内容
【题目】黄铜矿是工业炼铜的主要原料,主要成分为CuFeS2,含少量脉石。为测定该黄铜矿的纯度,某同学设计了如下实验:
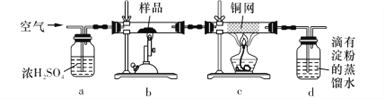
现用电子天平称取研细的黄铜矿样品1.150 g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05 mol L-1标准碘溶液进行滴定,消耗标准碘溶液20. 00 mL。请回答下列问题:
(1)将样品研细后再进行反应,其目的是_____________________;标准碘溶液应盛放在___________(填“碱式”或“酸式”)滴定管中。
(2) a装置的作用是__________________(填字母代号)。
A.除去空气中的二氧化碳
B.除去空气中的水蒸气
C有利于气体混合
D.有利于观察、控制空气流速
(3)若去掉c装置,会使测定结果_______________(填“偏低”“偏高”或“无影响”),写出影响测定结果的化学方程式:________________________。
(4)上述反应结束后,仍需通一段时间的空气,其目的是___________________________。
(5)通过计算可知,该黄铜矿的纯度为_________________________。
(6) 假设实验操作均正确,测得的黄铜矿纯度仍然偏低,可能的原因主要有_____________________。
【答案】 增大反应接触面积,加快化学反应速率 酸式 BD 偏低 2SO2+2H2O+O2=2H2SO4 将滞留在b、c装置中的二氧化硫全部导入d装置中,使二氧化硫全部被d装置中的蒸馏水吸收 80% 水吸收二氧化硫不充分,吸收速率慢
【解析】由已知结合实验装置图可得,该实验通过测定黄铜矿受热分解产生的二氧化硫的量,结合元素守恒确定黄铜矿的量,最后计算其纯度。
(1)增大固体的表面积可以加快化学反应速率,所以将样品研细后再进行反应,即增大了固体的表面积,目的是增大反应接触面积,加快化学反应速率,使原料充分反应;碘单质具有强氧化性,所以标准碘溶液应盛放在酸式滴定管中。
(2)要在高温条件下使样品与空气中的氧气反应,所以装置a中盛有浓硫酸可以吸收空气中的水蒸气,同时根据冒出气泡的快慢来控制空气流速,故选BD。
(3)c装置的作用是除去过量氧气,若去掉c装置,则d中会发生反应:2SO2+2H2O+O2=2H2SO4,消耗SO2,使测定结果偏低。
(4)二氧化硫全部被吸收是该实验成功的关键,黄铜矿受热分解完毕后仍需通一段时间的空气,可以将滞留在b、c装置中的二氧化硫全部排入d装置中,使二氧化硫全部被d装置中的蒸馏水吸收,结果更准确。
(5)实验后取d中溶液的1/10置于锥形瓶中,用0.05 mol L-1标准碘溶液进行滴定,消耗标准碘溶液20.00 mL。滴定反应为:I2+SO2+2H2O=2HI+H2SO4,又根据S元素守恒得:2I2~2SO2~CuFeS2,消耗碘单质的物质的量为:0.05molL-1×0.02L=0.0010mol,所以样品中CuFeS2的质量为:0.5×0.0010mol×184g/mol×10=0.92g,所以其纯度是:0.92g÷1.150 g×100%=80%。
(6)该实验用蒸馏水吸收二氧化硫,吸收速率慢,吸收二氧化硫不充分,会导致测得的黄铜矿纯度偏低,若实验操作均正确,测得的黄铜矿纯度仍然偏低,则可能为上述原因。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】在四个恒容密闭容器中按左下表相应量充入气体,发生反应2N2O(g)![]() 2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如下图所示:
2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如下图所示:
容器 | 容积/L | 起始物质的量/mol | ||
N2O | N2 | O2 | ||
Ⅰ | V1 | 0.1 | 0 | 0 |
Ⅱ | 1.0 | 0.1 | 0 | 0 |
Ⅲ | V3 | 0.1 | 0 | 0 |
Ⅳ | 1.0 | 0.06 | 0.06 | 0.04 |
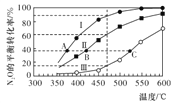
下列说法正确的是
A. 该反应的正反应放热
B. 相同温度下反应相同时间,平均反应速率:v(Ⅰ)>v(Ⅱ)
C. 容器Ⅳ在470℃进行反应时,起始反应速率:v正(N2O)<v逆(N2O)
D. 图中A、B、C三点处容器内总压强:pA(I)< pB(Ⅱ)<pC(Ⅲ)