题目内容
【题目】已知硫酸铜加热分解生成CuO、O2、SO2和SO3(g)。通过测定产生的三种气体的量可确定该反应的方程式。实验用到的仪器如下图所示。

有关操作和结果如下(已知:H++HSO3-=SO2↑+H2O)。
①准确称取一定质量的无水CuSO4固体充分加热到完全分解。
②实验后测得装置F总质量比实验前减少了0.96 g(忽略水蒸气的损失和SO2的溶解)。
③干燥管C在实验后质量增加3.84 g。
④由量筒中水的体积,折算出标准状况下相应气体的体积为224 mL。
试回答下列问题:
(1)装置C的作用是__________________,装置F的作用是______________。
(2)使用上图所给仪器装置(可重复使用),按从左到右的方向连接各仪器,接口顺序为①→⑨⑩→⑥⑤→________→________→________→②(填序号) 。
(3)装置F中发生反应的化学方程式为_______________________________________。
(4)请通过计算,推断出该条件下反应的化学方程式为_________________________。
【答案】吸收SO2吸收SO3③④ ⑥⑤(或③④) ⑧⑦SO3(g)+2NaHSO3=Na2SO4+2SO2+H2O(或SO3+H2O=H2SO4、H2SO4+2NaHSO3=Na2SO4+2SO2↑+2H2O)4CuSO4![]() 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
【解析】
(1)硫酸铜加热分解生成CuO、O2、SO2和SO3气体,根据题中提供的装置和药品可知,实验中用亚硫酸氢钠能吸收三氧化硫,用碱石灰吸收二氧化硫,所以装置C的作用是吸收二氧化硫,装置F的作用是吸收三氧化硫;
(2)气体的制备和收集按照发生装置→除杂装置→干燥气体→气体吸收装置→排水→测量装置来安装实验仪器,按从左至右的方向,先制备气体,通过亚硫酸氢钠吸收三氧化硫,再通过浓硫酸干燥二氧化硫气体和氧气,通过碱石灰吸收二氧化硫称量计算,为防止E中的水蒸气进入C装置,在C后面再连一个D装置,最后利用排水量气法测定氧气的体积,各仪器接口连接顺序为①⑨⑩⑥⑤③④⑥⑤⑧⑦②;
(3)三氧化硫与亚硫酸氢钠溶液反应生成硫酸钠和二氧化硫,反应方程式为SO3(g)+2NaHSO3=Na2SO4+2SO2+H2O或SO3+H2O=H2SO4、H2SO4+2NaHSO3=Na2SO4+2SO2↑+2H2O;
(4)实验后测得装置F总质量比实验前减少了0.96g,根据方程式SO3(g)+2NaHSO3=Na2SO4+2SO2+H2O可知,F中吸收的三氧化硫的物质的量为0.96/(64×2-80) mol=0.02mol,同是产生二氧化硫的物质的量为0.04mol,干燥管C吸收的物质是二氧化硫,二氧化硫包括硫酸铜分解生成的二氧化硫以及三氧化硫和水、亚硫酸氢钠反应生成的二氧化硫,二氧化硫的物质的量是3.84g÷64g/mol=0.06mol,所以原分解反应中生成的二氧化硫的物质的量为0.06mol-0.04mol=0.02mol;测得量筒B中水的体积,得出气体在标准状况下的体积为224mL,该气体是氧气,其物质的量是0.224L÷22.4L/mol=0.01mol,根据硫酸铜中铜元素与硫元素的关系可知,硫酸铜的物质的量为0.02mol+0.02mol=0.04mol,根据铜元素守恒可知,生成的氧化铜的物质的量为0.04mol,所以n(CuSO4):n(CuO):n(SO2):n(SO3):n(O2)=0.04mol:0.04mol:0.02mol:0.02mol:0.01mol=4:4:2:2:1,所以其分解方程式为4CuSO4![]() 4CuO+2SO3↑+2SO2↑+O2↑。
4CuO+2SO3↑+2SO2↑+O2↑。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在四个恒容密闭容器中按左下表相应量充入气体,发生反应2N2O(g)![]() 2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如下图所示:
2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如下图所示:
容器 | 容积/L | 起始物质的量/mol | ||
N2O | N2 | O2 | ||
Ⅰ | V1 | 0.1 | 0 | 0 |
Ⅱ | 1.0 | 0.1 | 0 | 0 |
Ⅲ | V3 | 0.1 | 0 | 0 |
Ⅳ | 1.0 | 0.06 | 0.06 | 0.04 |
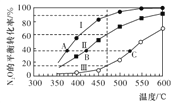
下列说法正确的是
A. 该反应的正反应放热
B. 相同温度下反应相同时间,平均反应速率:v(Ⅰ)>v(Ⅱ)
C. 容器Ⅳ在470℃进行反应时,起始反应速率:v正(N2O)<v逆(N2O)
D. 图中A、B、C三点处容器内总压强:pA(I)< pB(Ⅱ)<pC(Ⅲ)