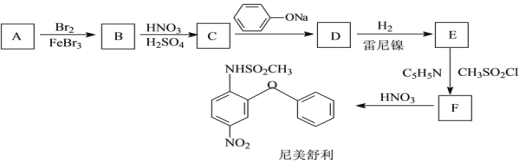
题目内容
【题目】铜是人类发现最早并广泛使用的一种金属。回答下列问题:
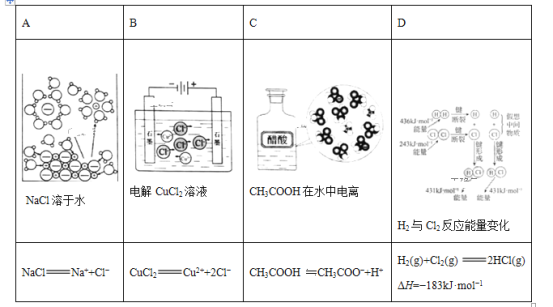
(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的化学方程式为___。
(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,写出该过程的离子方程式___,配制的FeCl3溶液应保持酸性,原因是__。
(3)溶液中Cu2+的浓度可采用碘量法测得:
①2Cu2++5I-=2CuI↓+I3-
②I3-+2S2O32-=S4O62-+3I-
现取20.00mL含Cu2+的溶液,加入足量的KI充分反应后,用0.1000mol·L-1的Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液25.00mL,此溶液中Cu2+的浓度为__mol·L-1。
【答案】Cu+H2SO4+H2O2=CuSO4+2H2O 2Fe3++Cu=2Fe2++Cu2+ 防止Fe3+水解 0.1250
【解析】
(1)实验室使用稀硫酸和H2O2溶解铜片,反应中Cu被氧化为Cu2+,据此写出反应的离子方程式;
(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,即Fe3+将Cu氧化为Cu2+,自身被还原为Fe2+,FeCl3溶液中Fe3+发生水解使溶液呈酸性,需保持溶液为酸性抑制Fe3+水解;
(3)根据滴定过程中发生的反应方程式计算。
(1)实验室使用稀硫酸和H2O2溶解铜片,反应中Cu被氧化为Cu2+,则发生反应的离子方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O;
(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,即Fe3+将Cu氧化为Cu2+,自身被还原为Fe2+,所以过程中发生的反应为:Cu+2Fe3+=Cu2++2Fe2+;FeCl3溶液中Fe3+发生水解使溶液呈酸性,需保持溶液为酸性以抑制Fe3+水解;
(3)取20.00mL含Cu2+的溶液,加入足量KI充分反应后,用0.1000mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液25.00mL,发生反应:I3-+2S2O32-=S4O62-+3I-,则消耗n(I3-)=![]() ×0.1000mol/L×25.00×10-3L=1.25×10-3mol,根据I元素守恒,则20.00mL溶液中c(Cu2+)=
×0.1000mol/L×25.00×10-3L=1.25×10-3mol,根据I元素守恒,则20.00mL溶液中c(Cu2+)=![]() mol/L=0.125mol/L。
mol/L=0.125mol/L。