题目内容
【题目】下列说法正确的是( )
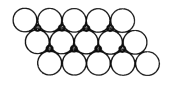
A. 按系统命名法,![]() 的名称为2,4,5-三甲基己烷
的名称为2,4,5-三甲基己烷
B. 3-甲基-3-乙基戊烷的一氯取代产物有6种
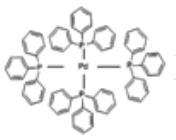
C. 化合物![]() 是苯的同系物
是苯的同系物
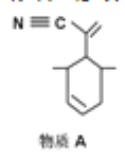
D. 分子![]() 中,位于同一平面上碳原子最多有6个
中,位于同一平面上碳原子最多有6个
【答案】D
【解析】![]() 为烷烃的键线式,其最长碳链含有6个C,主链为己烷,编号从右端开始,在2、3、5号C各含有1个甲基,该有机物正确名称为:2,3,5-三甲基己烷,A错误;3-甲基-3-乙基戊烷的结构简式为:
为烷烃的键线式,其最长碳链含有6个C,主链为己烷,编号从右端开始,在2、3、5号C各含有1个甲基,该有机物正确名称为:2,3,5-三甲基己烷,A错误;3-甲基-3-乙基戊烷的结构简式为:![]() ,该有机物碳架为:
,该有机物碳架为: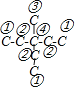 ,分子中含有4种碳原子,其中(4)号C不含H原子,所以分子中含有3种等效氢原子,其一氯代物有3种, B错误;
,分子中含有4种碳原子,其中(4)号C不含H原子,所以分子中含有3种等效氢原子,其一氯代物有3种, B错误;![]() 分子中含有3个苯环,与苯的结构不相似,一定不属于苯的同系物, C错误;
分子中含有3个苯环,与苯的结构不相似,一定不属于苯的同系物, C错误;![]() 分子中,根据乙烯中所有原子共平面、乙炔中所有原子共直线可以知道,该有机物分子中所有C原子可以共平面,即位于同一平面上碳原子最多有6个, D正确;正确选项D。
分子中,根据乙烯中所有原子共平面、乙炔中所有原子共直线可以知道,该有机物分子中所有C原子可以共平面,即位于同一平面上碳原子最多有6个, D正确;正确选项D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目