题目内容
14.将洁净的金属片Fe、Zn、A、B 分别与Cu用导线连结浸在合适的电解质溶液里.实验并记录电压指针的移动方向和电压表的读数如下表所示.根据以上实验记录,完成以下填空:| 金属 | 电子流动方向 | 电压/V |
| Fe | Fe→Cu | +0.78 |
| Zn | Zn→Cu | +1.10 |
| A | A←Cu | -0.15 |
| B | B→Cu | +0.3 |
②Cu与A组成的原电池,Cu为负极,此电极反应式为Cu-2e-=Cu2+.
③A、B形成合金,露置在潮湿空气中,B先被腐蚀.
分析 (1)Fe、Zn分别与Cu、电解质溶液形成原电池时电压的读数;根据原电池中,电子经导线从活泼金属流向不活泼金属;
(2)根据原电池中,活泼金属做负极,失去电子分析;
(3)根据原电池中,活泼金属做负极,被腐蚀分析.
解答 解:(1)Fe、Zn分别与Cu、电解质溶液形成原电池时,由表可知:前者的电压小,后者的电压大,而锌的活泼性大于铁,即金属活动性相差越大,电压表的读数越大;根据原电池中,电子经导线从活泼金属流向不活泼金属,由表可知:金属活泼性:Zn>Fe,Fe>Cu,Cu>A,B>Cu,利用金属活动性相差越大,电压表的读数越大可知Zn>B,所以金属的活泼性:Zn>Fe>B>Cu>A,
故答案为:大;Zn>Fe>B>Cu>A;
(2)根据原电池中,活泼金属做负极,失去电子,所以铜做负极,电极反应式:Cu-2e-=Cu2+,故答案为:Cu;Cu-2e-=Cu2+;
(3)根据原电池中,活泼金属做负极,被腐蚀,由(2)可知金属的活泼性:B>A,即B先被腐蚀,故答案为:B.
点评 本题结合表格考查原电池的工作原理,注意根据电子的流向判断电池的正负极以及金属活泼性强弱,培养了学生分析问题的能力,掌握了原电池工作原理的运用,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列各组物质中,都是共价化合物的是( )
| A. | H2O2和CaF2 | B. | H2S和Na2O2 | C. | HNO3和HClO4 | D. | NH3和N2 |
5.下列关于反应:XeF4+2CH3-CH=CH2?→2CH3CH2-CHF2+Xe的说法正确的是( )
| A. | XeF4被氧化 | B. | 该反应是非氧化还原反应 | ||
| C. | XeF4既是氧化剂又是还原剂 | D. | CH3-CH=CH2是还原剂 |
2.下列说法正确的是( )
| A. | 2NO(g)+2CO(g)═N2(g)+2CO2(g)该反应是熵减的反应 | |
| B. | 纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率减慢 | |
| C. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| D. | 由H2(g)+1/2O2(g)═H2O(g)△H=-241.8 kJ•mol-1,得出H2的燃烧热是241.8 kJ•mol-1 |
9.已知热化学方程式2SO2(g)+O2(g)?2SO3(g)△H=-QkJ/mol(Q>0),则下列说法正确的是( )
| A. | 2molSO2(g)和1molO2(g)所具有的内能小于2molSO3(g)所具有的内能 | |
| B. | 将2molSO2(g)、1molO2(g)置于一密闭容器中充分反应后放出QkJ的热量 | |
| C. | 升高温度,平衡向逆反应移动,上述热化学方程式中的Q值减小 | |
| D. | 如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,则此过程中有2molSO2(g)被氧化 |
19.下列化学式及结构式中,从成键情况看不合理的是( )
| A. | CH4Si: | B. | CH4S: | C. | CH2SeO: | D. | CH3N: |
6. 两种气态烃组成的混合气体,完全燃烧后得到C02和H2O的物质的量随着混合烃物质的量的变化如图所示.则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体,完全燃烧后得到C02和H2O的物质的量随着混合烃物质的量的变化如图所示.则下列对混合烃的判断正确的是( )
①一定有C2H4 ②一定有CH4③一定有C3H8④一定没有C2H6 ⑤可能有C2H2.
 两种气态烃组成的混合气体,完全燃烧后得到C02和H2O的物质的量随着混合烃物质的量的变化如图所示.则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体,完全燃烧后得到C02和H2O的物质的量随着混合烃物质的量的变化如图所示.则下列对混合烃的判断正确的是( )①一定有C2H4 ②一定有CH4③一定有C3H8④一定没有C2H6 ⑤可能有C2H2.
| A. | ②⑤ | B. | ②④ | C. | ③④ | D. | ①③ |
3.医学研究证明,用放射性${\;}_{53}^{136}$I治疗肿瘤可收到一定疗效,下列有关${\;}_{53}^{136}$I叙述正确的是( )
| A. | ${\;}_{53}^{136}$I是碘的一种同素异形体 | |
| B. | ${\;}_{53}^{136}$I位于元素周期表中第四周期ⅦA族 | |
| C. | ${\;}_{53}^{136}$I是一种新发现的元素 | |
| D. | ${\;}_{53}^{136}$I核内的中子数与核外电子数之差为29 |
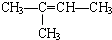 不属于烃类的是④(填序号,下同),与①互为同系物的是②,与③互为同分异构体的是⑤.
不属于烃类的是④(填序号,下同),与①互为同系物的是②,与③互为同分异构体的是⑤.