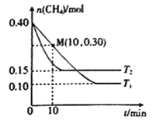
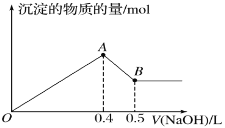
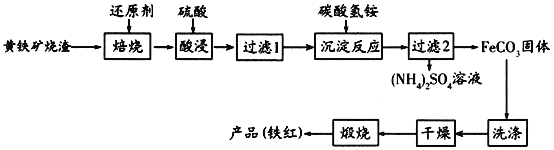
题目内容
【题目】某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-。现进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化。
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅳ.向Ⅱ中所得的溶液中加入过量浓氨水,仅有红褐色沉淀生成。过滤,在所得滤液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成。
请回答下列问题:
(1)该废水中一定含有的离子是_________________________。
(2)实验Ⅱ中加入少量盐酸生成无色气体的离子方程式是______________________。
(3)过滤除去Ⅳ中的蓝色沉淀,调整滤液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-+OH-→ AlO2-+NH3+N2+H2O(未配平)。还原产物是_________,若除去0.2 mol NO3-,要消耗铝________g。
【答案】Fe2+、Cu2+、NO3-、SO42- 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O NH3和N2 9.6
【解析】
I. 取少量溶液,加入KSCN溶液,无明显变化,证明溶液中不含Fe3+;
Ⅱ. 另取溶液加入盐酸,有无色气体生成,该无色气体遇空气变成红棕色,说明是一氧化氮被氧化为二氧化氮,证明原溶液中一定含有NO3和Fe2+,根据离子共存知,溶液中不能有CO32、SiO32;
Ⅲ. 向Ⅱ中所得溶液中加入BaCl2溶液,有白色沉淀生成,证明溶液中有SO42;
Ⅳ. 向Ⅱ中所得溶液中加入过量浓氨水,仅有红褐色沉淀生成,则生成氢氧化铁红褐色沉淀,溶液中没有Al3+,过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成,则生成氢氧化铜沉淀,则溶液中含有Cu2+,据此分析解得。
I. 取少量溶液,加入KSCN溶液,无明显变化,证明溶液中不含Fe3+;
Ⅱ. 另取溶液加入盐酸,有无色气体生成,该无色气体遇空气变成红棕色,说明是一氧化氮被氧化为二氧化氮,证明原溶液中一定含有NO3和Fe2+,根据离子共存知,溶液中不能有CO32、SiO32;
Ⅲ. 向Ⅱ中所得溶液中加入BaCl2溶液,有白色沉淀生成,证明溶液中有SO42;
Ⅳ. 向Ⅱ中所得溶液中加入过量浓氨水,仅有红褐色沉淀生成,则生成氢氧化铁红褐色沉淀,溶液中没有Al3+,过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成,则生成氢氧化铜沉淀,则溶液中含有Cu2+;
(1)由以上分析可知,该废水中一定含有的离子是Fe2+、Cu2+、NO3-、SO42-;
故答案为:Fe2+、Cu2+、NO3-、SO42-;
(2)实验II:另取溶液加入盐酸,有无色气体生成,该无色气体遇空气变成红棕色,说明是一氧化氮被氧化为二氧化氮,证明原溶液中一定含有NO3和Fe2+,NO3在酸性环境下具有强氧化性,能氧化Fe2+,生成NO和Fe3+、水,反应的离子方程式为:3Fe2++NO3-+4H+===3Fe3++NO↑+2H2O;
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(3)反应产生氨气和氮气的体积比为1:4,根据得失电子守恒、电荷守恒、元素守恒配平方程式为:16Al+9NO3+7OH=16AlO2+4N2↑+NH3↑+2H2O,含有元素化合价降低的生成物为还原产物,为NH3和N2;设除去0.2 mol NO3-,要消耗铝xg,根据方程式可列比例式,
16Al+9NO3+7OH=16AlO2+4N2↑+NH3↑+2H2O
16 9
x 0.2mol 则可得,![]() ,解得x=
,解得x=![]() ,则Al的质量为
,则Al的质量为![]() mol×27gmol1=9.6g;
mol×27gmol1=9.6g;
故答案为:NH3和N2;9.6。

【题目】氢能的存储是氢能应用的主要瓶颈,开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①基态Ti2+中含有的电子数为______,电子占据的最高能级是______,该能级具有的原子轨道数为______。
②BH4-中B原子的杂化方式是______。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______ H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 | I4/kJmol-1 | I5/kJmol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
该氢化物的化学式为______。
(3)液氨是富氢物质,是氢能的理想载体。
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是 ______。
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,该化合物的结构式为 ______。
(4)2008年,Yoon等人发现Ca与C60(分子结构如图1)生成的Ca32C60能大量吸附H2分子。
①C60晶体易溶于苯、CS2,C60是 ______ 分子(填“极性”或“非极性”)。
②1mol C60分子中,含有σ 键数目为 ______ 个(阿伏加德罗常数用NA表示)。

(5)某金属氢化物储氢材料的晶胞结构如图2所示,该金属氢化物的化学式为 ______,已知该晶体的密度为agcm-3,金属元素R的相对原子质量为M,阿伏加德罗常数为NA,则该晶胞的体积为 ______ cm3。