题目内容
16.原子序数小于10的元素X,其原子最外层中未成对电子数最多,含这种元素的阴离子可能是( )| A. | XO3- | B. | XO32- | C. | XO42- | D. | XO43- |
分析 原子序数小于10的元素X,其原子最外层中未成对电子数最多,p能级含有3个电子,故最外层电子数为5,该元素为N元素,结合化合价及形成的酸根离子判断.
解答 解:原子序数小于10的元素X,其原子最外层中未成对电子数最多,p能级含有3个电子,故最外层电子数为5,该元素为N元素,对应的酸根离子为XO3-,只有A符合.
故选A.
点评 本题考查原子结构与元素关系、元素的性质等,为高频考点,侧重于学生的分析能力的考查,注意把握核外电子排布特点,难度不大,推断元素是关键.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案
相关题目
6.有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素 原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2.E的阳离子与A的阴离子核外电子层结构完全相同.回答下列问题:
(1)五种元素的名称:A氧,C硫,E铝.
(2)画出A离子的结构示意图: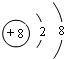
(3)B、C、D元素的原子半径由小到大的顺序为P>S>Cl(用元素符号表示),它们的最高价氧化物对应水化物的酸性强弱顺序为HClO4>H2SO4>H3PO4(用对应的酸表示)
(4)A与E形成的化合物的化学式是Al2O3,它的性质决定了它在物质的分类中应属于两性氧化物.
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量时,观察到的现象是先有白色胶状沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清,有关反应的离子方程式为Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2-+2H2O.
| A | ||
| B | C | D |
(2)画出A离子的结构示意图:
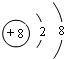
(3)B、C、D元素的原子半径由小到大的顺序为P>S>Cl(用元素符号表示),它们的最高价氧化物对应水化物的酸性强弱顺序为HClO4>H2SO4>H3PO4(用对应的酸表示)
(4)A与E形成的化合物的化学式是Al2O3,它的性质决定了它在物质的分类中应属于两性氧化物.
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量时,观察到的现象是先有白色胶状沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清,有关反应的离子方程式为Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2-+2H2O.
4.等质量的铜片,在酒精灯上加热后,分别插入下列溶液中,放置片刻后取出,铜片质量比加热前增加的是( )
| A. | 硝酸 | B. | 无水乙醇 | C. | 石灰水 | D. | 盐酸 |
11.下列是几种原子的基态电子排布,电负性最大的原子是( )
| A. | 1s22s22p4 | B. | 1s22s22p63s23p3 | ||
| C. | 1s22s22p3 | D. | 1s22s22p63s23p64s2 |
1.氯气跟碘在加热条件下,以等物质的量进行反应,可得到一种红棕色液体ICl.ICl有很强的氧化性,ICl跟Zn、H2O反应的化学方程式为:2ICl+2Zn=ZnCl2+ZnI2、ICl+H2O=HCl+HIO,下列叙述中正确的是( )
| A. | ZnCl2既是氧化产物,又是还原产物 | |
| B. | ICl跟H2O的反应是自身氧化还原反应 | |
| C. | ZnI2既是氧化产物,又是还原产物 | |
| D. | 在ICl跟H2O的反应中,ICl是氧化剂,H2O是还原剂 |
8.将一定量的NaOH和NaHCO3的混合物放在密闭的容器中加热,充分反应后生成CO2的体积为2.24L.将反应后的固体残渣与过量的稀盐酸反应,又生成3.36L的CO2.(以上或以下气体体积均为标准状况时的体积),下列判断正确的是( )
| A. | 原固体混合物中NaHCO3的物质的量为0.2mol | |
| B. | 固体残渣的成分为NaOH和Na2CO3的混合物 | |
| C. | 原固体混合物中NaOH和NaHCO3的物质的量之比为2﹕5 | |
| D. | 原固体混合物中加入过量盐酸会放出5.6L气体 |
5.某元素R原子最外层电子数为电子总数的$\frac{1}{3}$,该元素的氧化物可能是( )
| A. | R2O | B. | R2O2 | C. | RO2 | D. | R2O5 |
6.下列实验能证明某溶液中含铵根离子的是( )
| A. | 向溶液中加入石蕊试液后,呈蓝色 | |
| B. | 向溶液中加入酚酞试液后,呈红色 | |
| C. | 将溶液在试管中加热至沸腾,试管口放置的红色石蕊试纸变蓝色 | |
| D. | 将溶液中加入过量烧碱溶液加热至沸腾,试管口放置的红色石蕊试纸变蓝色 |
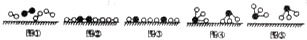
 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.