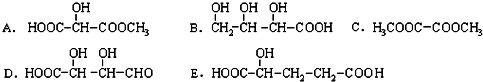题目内容
4.等质量的铜片,在酒精灯上加热后,分别插入下列溶液中,放置片刻后取出,铜片质量比加热前增加的是( )| A. | 硝酸 | B. | 无水乙醇 | C. | 石灰水 | D. | 盐酸 |
分析 铜和氧气在加热条件下反应生成氧化铜,铜在酒精灯上加热后,分别插入下列溶液中,放置片刻后取出,铜片质量比加热前增加,说明生成的氧化铜不反应,以此解答.
解答 解:铜片在酒精灯上加热后生成CuO,质量增加,
A.投入硝酸片刻,发生反应:CuO+2HNO3═Cu(NO3)2+H2O,Cu2+进入溶液,铜片的质量会减小,故A不选;
B.投入无水乙醇中,发生反应:CH3CH2OH+CuO→CH3CHO+H2O+Cu,又恢复为铜,铜片的质量不变,故B不选;
C.投入石灰水中,氧化铜不与石灰水反应,铜片质量增加,故C选;
D.投入盐酸中,氧化铜与盐酸反应生成氯化铜和水,质量减小,故D不选.
故选C.
点评 本题考查铜以及乙醇、硝酸等物质的性质,为高频考点,把握物质的性质及发生的反应为解答的关键,注意乙醇、乙醛的氧化反应条件,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列有关物质性质的比较顺序中,不正确的是( )
| A. | 热稳定性:HF>HCl>HBr>HI | B. | 微粒半径:K+>Na+>Mg2+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 还原性:Al>Mg>Na |
12.用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol碳正离子CH5+所含的电子数为11NA | |
| C. | 标准状态下,16g甲烷完全燃烧所消耗的氧气的分子数为2NA | |
| D. | 0.5molC3H8分子中含C-H共价键2NA |
16.原子序数小于10的元素X,其原子最外层中未成对电子数最多,含这种元素的阴离子可能是( )
| A. | XO3- | B. | XO32- | C. | XO42- | D. | XO43- |
13.下列各组物质中,互为同分异构体的是( )
| A. | CH3-CH2-CH2-CH2-CH3和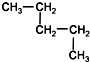 | B. | 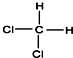 和 和 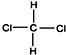 | ||
| C. | CH3-CH3和CH3-CH2-CH3 | D. | 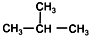 和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
14.在通常条件下,下列各组物质的性质排列不正确的是( )
| A. | 沸点:乙烷>戊烷>2-甲基丁烷 | B. | 熔点:Al>Na>Na和K的合金 | ||
| C. | 密度:苯<水<1,1,2,2-四溴乙烷 | D. | 热稳定性:HF>HCl>H2S |
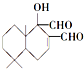 是一种取代有机氯农药DDT杀虫剂,其分子式为C15H22O3,它含有3种官能团,官能团的名称分别是碳碳双键、羟基、醛基
是一种取代有机氯农药DDT杀虫剂,其分子式为C15H22O3,它含有3种官能团,官能团的名称分别是碳碳双键、羟基、醛基 .
.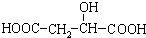 )广泛存在于水果中,尤以苹果、葡萄、西瓜、山
)广泛存在于水果中,尤以苹果、葡萄、西瓜、山