题目内容
13.下列有关碱金属元素的叙述正确的是( )| A. | 氢氧化铯碱性强于氢氧化钠 | |
| B. | 碱金属单质从Li到Cs,熔点依次升高 | |
| C. | 碱金属单质均为银白色,从Li到Cs,密度逐渐增大 | |
| D. | 碱金属元素形成的阳离子,从Li+到Cs+,氧化性依次增强 |
分析 A.元素金属性越强,最高价氧化物对应水化物的碱性越强;
B.都是金属晶体,同主族自上而下熔沸点降低;
C.Cs略带金色光泽,只有Li、Na、K的密度小于水;
D.元素金属性越强,阳离子氧化性越弱.
解答 解:A.同主族自上而下元素金属性增强,最高价氧化物对应水化物的碱性增强,故碱性氢氧化铯碱性强于氢氧化钠,故A正确;
B.随着原子序数的增加,碱金属原子的半径依次增大,金属键依次越弱,熔点依次降低,故B错误;
C.Cs略带金色光泽,只有Li、Na、K的密度小于水,故C错误;
D.同主族元素从上到下,金属性依次增强,即金属性:Li<Na<K<Rb<Cs,元素金属性越强,阳离子氧化性越弱,故从Li+到Cs+氧化性依次减弱,故D错误,
故选A.
点评 本题考查碱金属元素、单质、化合物性质的递变规律,难度不大,依据周期表中同主族元素性质的递变规律解答.

练习册系列答案
相关题目
18.在体积为1L的密闭容器中,某反应A(?)+2B(?)?2C(g)达到平衡后,测得C的物质的量浓度为1 mol•L-1,在恒温条件下,将体积扩大到1.5L后,测得平衡状态下C的浓度0.75mol•L-1.则有关说法正确的是( )
| A. | A、B均为气体,平衡逆向移动 | B. | A为气体,平衡正向移动 | ||
| C. | B为气体,平衡不移动 | D. | A、B都不是气体,平衡正向移动 |
19.下列各组物质中属于同分异构体的是( )
| A. | 葡萄糖与蔗糖 | |
| B. | O2和O3 | |
| C. | $\left.\begin{array}{l}{12}\\{6}\end{array}\right.$C与$\left.\begin{array}{l}{13}\\{6}\end{array}\right.$C | |
| D. |  |
8.工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)?N2(g)+CO2(g)△H=akJ•mol-1
在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:下列说法不正确的是( )
在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:下列说法不正确的是( )
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
| A. | 10min内,T1时CH4的化学反应速率比T2时小 | |
| B. | T1<T2 | |
| C. | 平衡常数:K(T1)<K(T2) | |
| D. | a<0 |
2.如表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: .
.
(3)最高价氧化是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=AlO2-+2H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(5)表示①与⑦的化合物的电子式 .
.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
 .
.(3)最高价氧化是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=AlO2-+2H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程:
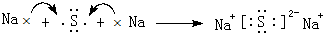 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(5)表示①与⑦的化合物的电子式
 .
.