题目内容
18.在体积为1L的密闭容器中,某反应A(?)+2B(?)?2C(g)达到平衡后,测得C的物质的量浓度为1 mol•L-1,在恒温条件下,将体积扩大到1.5L后,测得平衡状态下C的浓度0.75mol•L-1.则有关说法正确的是( )| A. | A、B均为气体,平衡逆向移动 | B. | A为气体,平衡正向移动 | ||
| C. | B为气体,平衡不移动 | D. | A、B都不是气体,平衡正向移动 |
分析 保持温度不变,将容器的体积扩大1.5L后,如平衡不移动,C的浓度为$\frac{1}{1.5}$mol/L=$\frac{2}{3}$mol/L,小于实际C的浓度变为0.75mol/L,说明平衡向生成C的方向移动,即向正反应移动,据此结合选项解答.
解答 解:保持温度不变,将容器的体积扩大1.5L后,如平衡不移动,C的浓度为$\frac{1}{1.5}$mol/L=$\frac{2}{3}$mol/L,小于实际C的浓度变为0.75mol/L,说明平衡向生成C的方向移动,即向正反应移动,
A、增大体积,压强减小,平衡向向正反应移动即气体体积增大的方向,所以B为非气体,故A错误;
B、增大体积,压强减小,平衡向向正反应移动即气体体积增大的方向,所以A为气体,B为非气体,故B正确;
C、增大体积,压强减小,平衡向向正反应移动即气体体积增大的方向,所以B为非气体,故C错误;
D、增大体积,压强减小,平衡向向正反应移动即气体体积增大的方向,所以A、B可以都不是气体,故D正确;
故选:BD.
点评 本题考查化学平衡移动,难度中等,利用假设法判断平衡移动方向是解题关键.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
6. A~E五种元素均位于周期表的前四周期,有关它们的信息如下表所示:
A~E五种元素均位于周期表的前四周期,有关它们的信息如下表所示:
回答下列问题
(用元素符号表示):
(1)C元素基态原子的价电子排布图为
(2)[E(A2C)4]2+中E2+与A2C间的作用为B(填字母编号
A.离子键 B.配位键 C.金属键 D.分子间作用力
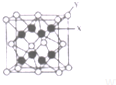
(3)D2C的晶胞结构与CaF2晶胞(如图)相似,则X应为K+
D2C的熔点比CaF2的熔点低(填“高”、“低”、“无法比较”)
(4)与B2C互为等电子体分子为CO2,其分子的立体构型为直线型
(5)已知:A2(g)+$\frac{1}{2}$C2(g)=A2C(g)△H1=-akJ/mol
B2(g)+3A2(g)=2BA3(g)△H2=-bkJ/mol
则34gBA3(g)与C2(g)反应生成B2(g)与A2C(g)时,该反应的热化学反应方程式为2NH3(g)+$\frac{3}{2}$O2(g)=N2(g)+3H2O(g)△H=(b-3a)kJ/mol.
 A~E五种元素均位于周期表的前四周期,有关它们的信息如下表所示:
A~E五种元素均位于周期表的前四周期,有关它们的信息如下表所示:回答下列问题
| 元素 | 相关信息 |
| A | 元素A是周期表中原子半径最小的元素 |
| B | B的单质由双原子分子构成,分子中有14个电子 |
| C | C3单质在大气层的平流层中,其浓度的减少会导致人患皮肤癌 |
| D | D是前四周期元素中第一电离能最小的元素 |
| E | E位于ds区且原子的最外层电子数与A相同 |
(1)C元素基态原子的价电子排布图为

(2)[E(A2C)4]2+中E2+与A2C间的作用为B(填字母编号
A.离子键 B.配位键 C.金属键 D.分子间作用力
(3)D2C的晶胞结构与CaF2晶胞(如图)相似,则X应为K+
D2C的熔点比CaF2的熔点低(填“高”、“低”、“无法比较”)
(4)与B2C互为等电子体分子为CO2,其分子的立体构型为直线型
(5)已知:A2(g)+$\frac{1}{2}$C2(g)=A2C(g)△H1=-akJ/mol
B2(g)+3A2(g)=2BA3(g)△H2=-bkJ/mol
则34gBA3(g)与C2(g)反应生成B2(g)与A2C(g)时,该反应的热化学反应方程式为2NH3(g)+$\frac{3}{2}$O2(g)=N2(g)+3H2O(g)△H=(b-3a)kJ/mol.
3.用括号中的试剂除去各组物质中的少量杂质正确的是( )
| A. | 苯中的甲苯(溴水) | B. | 乙烷中的乙烯(氢气) | ||
| C. | 溴苯中的溴(碘化钾溶液) | D. | 乙醇中的水(新制的CaO) |
10.某探究小组用如图所示装置进行如下实验,其实验现象描述正确的是( )
| 选项 | a中试剂 | b中试剂 | 实验现象 | 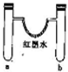 |
| A | 1mL12mol•L-1浓盐酸0.5gMnO2 | 0.1gCaCO3、1mL 2mol•L-1盐酸 | 红墨水褪色,U形管中液面左右基本持平 | |
| B | 0.1gNa3mol水 | 0.1gNa 3mol乙醇 | 反应开始阶段,反应结束静置一段时间后U形管中液面都是左低右高 | |
| C | 3mL浓硫酸、铁钉 | 3mLNaCl溶液、铁钉 | 铁钉均生锈,U形管中液面左高右低 | |
| D | 3mL水 | 3mL饱和FeSO4溶液 | 一段时间后,U形管中液面左低右高,b管溶液中出现红褐色浑浊物 |
| A. | A | B. | B | C. | C | D. | D |
7.如表实验设计,能达到相应实验目的是( )
| 序号 | 实验目的 | 实验设计 |
| A | 证明CH2═CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| B | 鉴别碳酸钠溶液与碳酸氢钠溶液 | 分别加入少量的氢氧化钠溶液,观察现象 |
| C | 实验室制取少量O2气体 | 将蒸馏水滴入过氧化钠固体中,用排水法收集产生的气体 |
| D | 除去硫酸铜溶液中少量的硫酸铁 | 加入过量铜粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
13.下列有关碱金属元素的叙述正确的是( )
| A. | 氢氧化铯碱性强于氢氧化钠 | |
| B. | 碱金属单质从Li到Cs,熔点依次升高 | |
| C. | 碱金属单质均为银白色,从Li到Cs,密度逐渐增大 | |
| D. | 碱金属元素形成的阳离子,从Li+到Cs+,氧化性依次增强 |
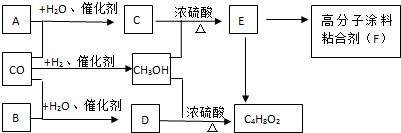
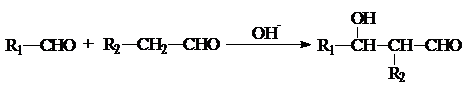 .有机物G(C20H18O4)是一种酯,合成路线如下:
.有机物G(C20H18O4)是一种酯,合成路线如下:
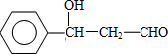 ,F 的结构简式是CH2OHCH2OH;
,F 的结构简式是CH2OHCH2OH;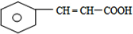 +CH2OHCH2OH$→_{△}^{浓硫酸}$
+CH2OHCH2OH$→_{△}^{浓硫酸}$ +2H2O;
+2H2O;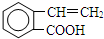
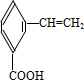 、
、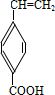 、
、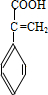 .
.
 .
.