题目内容
18.已知X、M都是中学教材常见元素,下列对甲、乙两个离子反应通式的推断中,(甲)XO3n-+Xn-+H+→X单质+H2O(未配平);(乙)Mm++mOH-=M(OH)m↓,其中正确的是( )①若n=1,则XO3n-中X元素为+5价,X位于周期表第ⅤA族
②若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
③若m=2,则在空气中蒸干MSO4溶液并灼烧一定能得到MSO4
④若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
⑤若m=3,则MCl3与足量的碱溶液反应一定生成M(OH)m.
| A. | ①③ | B. | ②④ | C. | ①②③④ | D. | ①⑤ |
分析 ①n=1,XO3n-中X元素为+5价,X元素形成X-离子,X最低价为-1,处于第ⅦA族;
②m=1,+1价阳离子有:Ag+、Na+、K+等,硝酸银溶液滴入氨水,生成银氨溶液无明显现象;将氨水滴入硝酸银溶液中产生沉淀,继续滴加沉淀溶解;
③m=2,若M为Fe,硫酸亚铁中+2价铁在空气中易被氧化为+3价;
④n=2,X元素形成X2-离子,X最低价为-2,只有X为硫符合题意;
⑤m=3,常见金属中只有铁、铝符合条件.
解答 解:①n=1,XO3n-中X元素为+5价,X元素形成X-离子,X最低价为-1,处于第ⅦA族,故①错误;
②m=1,+1价阳离子有:Ag+、Na+、K+等,氢氧化银不溶于水,但可以溶于氨水,硝酸银溶液滴入氨水,生成银氨溶液无明显现象;将氨水滴入硝酸银溶液中产生沉淀,继续滴加沉淀溶解,互滴顺序不同现象不同,故②正确;
③m=2,若M为Fe,硫酸亚铁中+2价铁在空气中易被氧化为+3价,硫酸亚铁溶液经蒸干、灼烧不可能达到硫酸亚铁,故③错误;
④n=2,X元素形成X2-离子,X最低价为-2,只有X为硫符合题意,浓硫酸含有强氧化性,可以氧化硫化氢,故④正确;
⑤m=3,常见金属中只有铁、铝符合条件,氯化铝和过量氢氧化钠反应最终没有氢氧化铝沉淀生成,故⑤错误;
故选B.
点评 本题考查元素化合物的推断,属于开放性题目,题目综合性较大,需要学生熟练掌握元素化合物知识,难度中等.

练习册系列答案
相关题目
15.常温下,已知某水溶液中由水电离出c(H+)=10-14mol/L,溶液中可能含有①Fe2+②Cl-③HC${{O}_{3}}^{-}$④Na+⑤N${{O}_{3}}^{-}$⑥Al3+,一定能大量共存的离子组合为( )
| A. | ②④ | B. | ①⑤ | C. | ④⑤ | D. | ③⑥ |
6. 氮氧化物能造成光化学烟雾,引起大气污染,用以下方法可以消除.
氮氧化物能造成光化学烟雾,引起大气污染,用以下方法可以消除.
Ⅰ.活性炭还原法处理氮氧化物.若向2L密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应生成甲和乙,甲和乙均为参与大气循环的物质,反应进行到不同时间测得各物质的物质的量浓度如下:
(1)该反应的化学方程式为C+2NO?N2+CO2
(2)T1℃时,该反应的平衡常数K=0.56(保留两位小数)
(3)30min时改变的条件是分离出乙.若30min后升高温度至T2,达到平衡时,容器中NO、甲、乙的浓度之比为2:1:1,则反应的△H<0(填“<”、“=”、“>”).
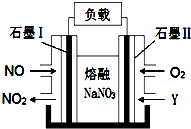
Ⅱ.以NO、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨电极Ⅰ生成NO2.
(4)石墨电极Ⅰ的反应式为NO2+NO3--e-=N2O5;为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,即必须在石墨电极Ⅱ电极处通入一种氧化物Y,Y是N2O5(填物质的化学式).
Ⅲ.CH4催化还原法.已知:
①CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(l)△H=-622kJ/mol
②CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(l)△H=-955kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
(5)写出CH4(g)与NO(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式CH4(g)+4NO(g)?2N2(g)+CO2(g)+2H2O(g)△H=-1200kJ/mol.
(6)恒容时,甲烷与二氧化氮在一定条件下只发生①反应,下列各项中能够判断该反应一定达平衡的是BC(填写正确选项的字母).
A.混合气体的总压强不改变
B.混合气体的相对分子质量不再改变
C.混合气体的密度不再改变
D.v(CH4)正=4v(NO)逆E.c(NO):c(CO2)=4:1.
 氮氧化物能造成光化学烟雾,引起大气污染,用以下方法可以消除.
氮氧化物能造成光化学烟雾,引起大气污染,用以下方法可以消除.Ⅰ.活性炭还原法处理氮氧化物.若向2L密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应生成甲和乙,甲和乙均为参与大气循环的物质,反应进行到不同时间测得各物质的物质的量浓度如下:
浓度(mol/L) 时间(min) | NO | 甲 | 乙 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
(2)T1℃时,该反应的平衡常数K=0.56(保留两位小数)
(3)30min时改变的条件是分离出乙.若30min后升高温度至T2,达到平衡时,容器中NO、甲、乙的浓度之比为2:1:1,则反应的△H<0(填“<”、“=”、“>”).
Ⅱ.以NO、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨电极Ⅰ生成NO2.
(4)石墨电极Ⅰ的反应式为NO2+NO3--e-=N2O5;为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,即必须在石墨电极Ⅱ电极处通入一种氧化物Y,Y是N2O5(填物质的化学式).
Ⅲ.CH4催化还原法.已知:
①CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(l)△H=-622kJ/mol
②CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(l)△H=-955kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
(5)写出CH4(g)与NO(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式CH4(g)+4NO(g)?2N2(g)+CO2(g)+2H2O(g)△H=-1200kJ/mol.
(6)恒容时,甲烷与二氧化氮在一定条件下只发生①反应,下列各项中能够判断该反应一定达平衡的是BC(填写正确选项的字母).
A.混合气体的总压强不改变
B.混合气体的相对分子质量不再改变
C.混合气体的密度不再改变
D.v(CH4)正=4v(NO)逆E.c(NO):c(CO2)=4:1.
3.下列说法错误的是( )
| A. | 气体的体积主要由所含微粒数目、微粒大小和微粒之间的距离决定 | |
| B. | 除去氯化钠溶液中的泥沙最简单的操作方法是过滤 | |
| C. | 0.012Kg C-12中所含的原子数称为阿伏加德罗常数 | |
| D. | 地球上99%以上的溴蕴藏在大海中,因此溴被称为“海洋元素” |
10.有①Na2CO3溶液②CH3COONa溶液③NaOH溶液各25mL,物质的量浓度均为0.1mol•L-1,下列说法正确的是( )
| A. | 3种溶液pH的大小顺序是③>②>① | |
| B. | 若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② | |
| C. | 若将3种溶液稀释相同倍数,pH变化最大的是② | |
| D. | 若分别加入25mL 0.1mol•L-1盐酸后,pH最大的是① |
7.在一定温度下,将一定质量的混合气体在密闭容器中发生反应aA(g)+bB(g)?cC(g)+dD(g),达到平衡时测得B气体的浓度为0.6mol/l,恒温下将密闭容器的容积扩大一倍,重新达到平衡时,测得B气体的浓度为 0.4mol/l,下列叙述中正确的是( )
| A. | a+b>c+d | B. | 平衡向右移动 | ||
| C. | 重新达平衡时,A气体浓度增大 | D. | 重新达平衡时,B的体积分数减小 |
8.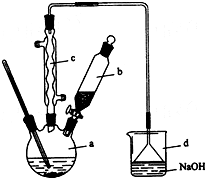 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了HBr气体.继续滴加至液溴滴完.装置d的作用是吸收HBr和Br2;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用l0mL水、8mL l0%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;第二次用水洗涤的作用是洗去NaOH.分液时C,(填序号).
A.直接将溴苯从分液漏斗上口倒出
B.直接将溴苯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将溴苯从下口放出
D.先将水层从分液漏斗的下口放出,再将溴苯从上口倒出
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是作干燥剂;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL
(5)该反应是否要加热C(填下列字母)
A.直接加热 B.水浴加热 C.不需加热
(6)粗溴苯经分离提纯后得纯溴苯为3.9g,则溴苯产率是32%(取整数).
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g?cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了HBr气体.继续滴加至液溴滴完.装置d的作用是吸收HBr和Br2;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用l0mL水、8mL l0%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;第二次用水洗涤的作用是洗去NaOH.分液时C,(填序号).
A.直接将溴苯从分液漏斗上口倒出
B.直接将溴苯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将溴苯从下口放出
D.先将水层从分液漏斗的下口放出,再将溴苯从上口倒出
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是作干燥剂;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL
(5)该反应是否要加热C(填下列字母)
A.直接加热 B.水浴加热 C.不需加热
(6)粗溴苯经分离提纯后得纯溴苯为3.9g,则溴苯产率是32%(取整数).
 硼酸(H3BO3)在食品、医药领域应用广泛.
硼酸(H3BO3)在食品、医药领域应用广泛.