题目内容
10.有①Na2CO3溶液②CH3COONa溶液③NaOH溶液各25mL,物质的量浓度均为0.1mol•L-1,下列说法正确的是( )| A. | 3种溶液pH的大小顺序是③>②>① | |
| B. | 若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② | |
| C. | 若将3种溶液稀释相同倍数,pH变化最大的是② | |
| D. | 若分别加入25mL 0.1mol•L-1盐酸后,pH最大的是① |
分析 A.等浓度时强碱的pH最大;强碱弱酸盐中对应的酸酸性越强,水解程度越小,酸性越强,pH越小;
B.pH相同时,碱的浓度最小,盐的水解程度越小,盐的浓度越大;
C.稀释时强碱的变化程度大;
D.分别加入25mL 0.1mol•L-1盐酸后,均与盐酸等物质的量反应,根据产物的性质分析.
解答 解:A.等浓度时强碱的pH最大,强碱弱酸盐中对应的酸性越强,水解程度越小,碳酸氢根离子的酸性小于醋酸,所以3种溶液pH的大小顺序是③>①>②,故A错误;
B.pH相同时,碱的浓度最小,盐的水解程度越小,盐的浓度越大,若3种溶液的pH均为9,则物质的量浓度的大小顺序是②>①>③,故B错误;
C.稀释时强碱的变化程度大,所以三种溶液稀释相同倍数,pH变化最大的是③,故C错误;
C.等体积等浓度混合后,①中溶质为NaHCO3、NaCl,②中溶质为NaCl、CH3COOH,③中溶质为NaCl,而HCO3-离子水解显碱性,所以pH最大的是①,故C错误;
D.分别加入25mL 0.1mol•L-1盐酸后,均与盐酸等物质的量反应,①Na2CO3溶液反应生成碳酸氢钠,溶液显碱性,②CH3COONa溶液生成醋酸溶液显酸性,③NaOH与HCl反应生成NaCl,溶液显中性,所以pH最大的是①,故D正确;
故选:D.
点评 本题考查盐类水解、pH的判断等,明确酸碱混合的计算,盐类水解的规律、pH与浓度的关系等知识即可解答,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
1.现有容积均为500mL的甲、乙两个密闭容器(甲容器恒温恒容,乙容器恒容绝热),500℃时向两容器中分别充入1mol N2和2.5mol H2,发生反应:N2+3H2═2NH3△H<0并达到平衡.下列有关说法不正确的是( )
| A. | 达平衡后,甲、乙两容器中气体的密度相同 | |
| B. | 甲容器中反应达平衡所需时间比乙容器中的长 | |
| C. | 达平衡后,甲容器中混合气体的平均摩尔质量比乙容器中的大 | |
| D. | 平衡时甲容器中c(N2)=1 mol/L,若再充入1.5 mol N2和1 mol NH3,H2的转化率变大 |
5.下列各组物质属于同位素的是( )
| A. | 氕、氘、氚 | B. | 金刚石和石墨 | C. | O2 和O3 | D. | C2H4和CH4 |
15.以下表示重氢原子结构或核外电子运动状态的图式中一定错误的是( )
| A. |  | B. | $\stackrel{1}{2}$H | C. | 1s1 | D. |  |
2.若某原子在处于能量最低状态时,外围电子排布为3d14s2,则下列说法正确的是( )
| A. | 该元素原子核外共有4个电子层 | |
| B. | 该元素原子最外层共有3个电子 | |
| C. | 该元素原子的M能层共有8个电子 | |
| D. | 该元素原子处于能量最低状态时,原子中共有3个未成对电子 |
19.下列物质与危险化学品标志的对应关系正确的是( )
| A. |  氯化钠 | B. |  乙醇 | C. |  木炭 | D. | 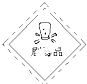 氢氧化钠 |
20.下列说法正确的是( )
| A. | 反应C(s)+CO2(g)=2CO(g)在室温下不能自发进行,说明该反应的△H<0 | |
| B. | 250℃和1.01×105Pa时,反应 2N2O5(g)=4NO2(g)+O2(g),△H=+56.76 kJ/mol,自发进行的原因熵增大效应大于能量效应 | |
| C. | 恒温时,向水中加入少量固体硫酸氢钠,水电离的c(H+)减小,水的离子积常数Kw减小 | |
| D. | 2CO(g)+2NO(g)=N2(g)+2CO2(g)在298K时能自发进行,则它的△H>0,△S>0 |