题目内容
7.在一定温度下,将一定质量的混合气体在密闭容器中发生反应aA(g)+bB(g)?cC(g)+dD(g),达到平衡时测得B气体的浓度为0.6mol/l,恒温下将密闭容器的容积扩大一倍,重新达到平衡时,测得B气体的浓度为 0.4mol/l,下列叙述中正确的是( )| A. | a+b>c+d | B. | 平衡向右移动 | ||
| C. | 重新达平衡时,A气体浓度增大 | D. | 重新达平衡时,B的体积分数减小 |
分析 保持温度不变,将容器的体积扩大1倍,如平衡不移动,B气体的浓度为0.3mol/L,小于实际B的浓度变为0.4mol/L,说明平衡向生成B的方向移动,即向逆反应移动,据此结合选项解答.
解答 解:保持温度不变,将容器的体积扩大1倍,如平衡不移动,B气体的浓度为0.3mol/L,小于实际B的浓度变为0.4mol/L,说明平衡向生成B的方向移动,即向逆反应移动.
A、增大体积,压强减小,平衡向逆反应移动,压强减小平衡向气体物质的量增大的方向移动,即a+b>c+d,故A正确;
B、依据分析判断,化学平衡逆向进行,故B错误;
C、体积加倍,各物质的浓度都要减小,即A气体浓度减小,故C错误;
D、平衡向逆反应移动,B的体积分数增大,故D错误;
故选:A.
点评 本题考查化学平衡移动,难度中等,利用假设法判断平衡移动方向是解题关键.

练习册系列答案
相关题目
15.以下表示重氢原子结构或核外电子运动状态的图式中一定错误的是( )
| A. |  | B. | $\stackrel{1}{2}$H | C. | 1s1 | D. |  |
2.若某原子在处于能量最低状态时,外围电子排布为3d14s2,则下列说法正确的是( )
| A. | 该元素原子核外共有4个电子层 | |
| B. | 该元素原子最外层共有3个电子 | |
| C. | 该元素原子的M能层共有8个电子 | |
| D. | 该元素原子处于能量最低状态时,原子中共有3个未成对电子 |
12.下列物质中属于有机物的是( )
| A. | 甲烷 | B. | 苏打 | C. | 水泥 | D. | 玻璃 |
19.下列物质与危险化学品标志的对应关系正确的是( )
| A. |  氯化钠 | B. |  乙醇 | C. |  木炭 | D. | 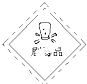 氢氧化钠 |
17.关于化学反应2A(g)+B(g)?3C(g)+D(g),下列反应速率表示反应最慢的是( )
| A. | v(A)=1.4 mol•L-1•s-1 | B. | v(B)=0.6mol•L-1•s-1 | ||
| C. | v(C)=1.5mol•L-1•s-1 | D. | v(D)=1.6mol•L-1•min-1 |
