题目内容
3.下列说法错误的是( )| A. | 气体的体积主要由所含微粒数目、微粒大小和微粒之间的距离决定 | |
| B. | 除去氯化钠溶液中的泥沙最简单的操作方法是过滤 | |
| C. | 0.012Kg C-12中所含的原子数称为阿伏加德罗常数 | |
| D. | 地球上99%以上的溴蕴藏在大海中,因此溴被称为“海洋元素” |
分析 A.温度、压强一定时,气体体积与微粒数目、微粒大小和微粒之间的距离有关;
B.泥沙不溶于水,氯化钠溶于水;
C.012Kg C-12中所含的原子数为NA个;
D.海水资源丰富,地球上99%以上的溴都蕴藏在汪洋大海中.
解答 解:A.气体体积与温度、压强、微粒数目、微粒大小和微粒之间均有关,温度、压强一定时,气体体积由微粒数目、微粒大小和微粒之间的距离决定,故A错误;
B.泥沙不溶于水,氯化钠溶于水,则除去氯化钠溶液中的泥沙最简单的操作方法是过滤,故B正确;
C.012Kg C-12中所含的原子数为NA个,即为阿伏加德罗常数,故C正确;
D.海水资源丰富,地球上99%以上的溴都蕴藏在汪洋大海中,因此溴被称为“海洋元素”,故D正确;
故选A.
点评 本题考查较综合,涉及气体体积的影响因素、混合物分离提纯、海水资源等,注重基础知识的考查,注意选项A为解答的易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.两种硫酸溶液,一种硫酸溶液的物质的量浓度为C1,密度为ρ1;另一种硫酸溶液的物质的量浓度为C2,密度为ρ2,将它们等体积混合后,所得溶液的密度为ρ3,则混合后硫酸的物质的量浓度为( )
| A. | $\frac{({C}_{1}+{C}_{2}){ρ}_{3}}{{ρ}_{1}+{ρ}_{2}}$ | B. | $\frac{{C}_{1}+{C}_{2}}{{ρ}_{1}+{ρ}_{2}}$ | ||
| C. | $\frac{({C}_{1}+{C}_{2}){ρ}_{3}}{1000({ρ}_{1}+{ρ}_{2})}$ | D. | $\frac{1000({C}_{1}+{C}_{2}){ρ}_{3}}{{ρ}_{1}+{ρ}_{2}}$ |
20.根据如表提供的数据,下列判断正确的是( )
| 化学式 | 电离常数 |
| HF | K=3.5×10-4 |
| H2CO3 | K1=4.3×10-7 |
| K2=5.6×10-11 | |
| HClO | K=3.2×10-8 |
| A. | 酸性强弱:KClO>H2CO3>HF | |
| B. | 同温同浓度下,溶液的pH值:NaF>NaClO>Na2CO3 | |
| C. | 次氯酸钠溶液中通少量二氧化碳的离子方程式:ClO-+CO2+H2O═HCO3-+HClO | |
| D. | 碳酸钠溶液中加入少量氢氟酸的离子方程式:CO${{\;}_{3}}^{2-}$+2HF═2F-+H2O+CO2↑ |
11.H2、NH3、HNO3、NH4NO3等都是重要的化工原料.
(1)工业上生产氢气的反应为:CO(g)+H2O(g)?CO2(g)+H2(g).在t℃时,向1L密闭容器中充入0.2mol CO(g)和0.3molH2O(g).反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下CO的转化率为60%,反应的平衡常数K=1
(2)工业上合成NH3的反应为:N2(g)+3H2(g)?2NH3(g)△H<0,下表为不同温度下该反应的平衡常数.由此可推知,表中T1<573K(填“>”、“<”或“=”).工业实际生产中需通入过量的空气,其目的是增大氢气利用率
(3)NH4NO3溶液呈酸性(填“酸性”、“碱性”或“中性”),其原因是:NH4++H2O?NH3.H2O+H+(用离子方程式表示)
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol;
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol.
则CH4直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1.
(1)工业上生产氢气的反应为:CO(g)+H2O(g)?CO2(g)+H2(g).在t℃时,向1L密闭容器中充入0.2mol CO(g)和0.3molH2O(g).反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下CO的转化率为60%,反应的平衡常数K=1
(2)工业上合成NH3的反应为:N2(g)+3H2(g)?2NH3(g)△H<0,下表为不同温度下该反应的平衡常数.由此可推知,表中T1<573K(填“>”、“<”或“=”).工业实际生产中需通入过量的空气,其目的是增大氢气利用率
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol;
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol.
则CH4直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1.
8.硝酸具有强氧化性,甲乙两组同学对硝酸的性质进行研究.
(1)甲组同学进行了铜与浓硝酸、稀硝酸反应的实验:
请回答:
①铜与稀硝酸反应的离子方程式是3Cu+8H++2NO3-(稀)═3Cu2++2NO?+4H2O.
②实验I能否说明溶液呈现不同颜色与硝酸铜的物质的量浓度无关?能(填“能”或“不能”),原因是两份溶液中硝酸铜的物质的量浓度相等.
③根据实验结果推测,铜与浓硝酸反应后溶液呈绿色的原因可能是反应生成的红棕色气体溶于生成的蓝色硝酸铜溶液.
④请另设计一个方案,验证你所得到的上述结论:方案一:取Cu与浓HNO3反应后的绿色溶液,向其中通入足量的空气(或氧气),溶液颜色由绿色逐渐变为蓝绿色,最终变为蓝色.
(2)乙组同学用足量浓硝酸和硫单质反应进行了实验探究.
假设硝酸的还原产物只有一种,乙组同学根据氧化还原反应推测硫的氧化产物,提出三种可能:I.只有硫酸;Ⅱ.只有二氧化硫;Ⅲ.二氧化硫和硫酸
乙组同学设计了下列实验,实验流程及步骤:
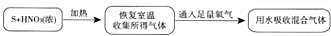
a.混合气体用水吸收后,测得无含硫、含氮物质逸出,并将吸收后的液体配成100.00mL溶液;
b.取a中所得溶液20.00mL,加入足量氯化钡溶液,得到0.466g白色沉淀;
c.再取20.00mLa中所得溶液,用氢氧化钠溶液中和,恰好用去0.6mol/L氢氧化钠溶液30.00mL.
请回答:
①二氧化氮和氧气的混合气体被水完全吸收的化学方程式为4NO2+O2+2H2O═4HNO3.
②步骤a中配制的100.00mL溶液中H+的物质的量浓度是0.9mol/L.
③该实验中收集到气体中含有NO2和SO2,假设III(填“I”“II”或“III”)成立.
④该实验中浓硝酸和硫反应的化学方程式为14HNO3(浓)+3S$\frac{\underline{\;△\;}}{\;}$2SO2↑+H2SO4+14NO2↑+6H2O.
(1)甲组同学进行了铜与浓硝酸、稀硝酸反应的实验:
| 实验组 | 实验操作 | 实验现象 |
| 实验1 | 在 I、II两支试管中分别加入等体积的浓硝酸和稀硝酸,再向两支试管中分别放入等质量的铜片. | 铜均无剩余,试管 I中溶液呈绿色;试管 II中溶液呈蓝色. |
| 实验2 | 分别取实验 I中的绿色溶液于 III、IV两试管中,对试管 III进行加热,向试管 IV中缓慢加入水,并不停振荡. |
①铜与稀硝酸反应的离子方程式是3Cu+8H++2NO3-(稀)═3Cu2++2NO?+4H2O.
②实验I能否说明溶液呈现不同颜色与硝酸铜的物质的量浓度无关?能(填“能”或“不能”),原因是两份溶液中硝酸铜的物质的量浓度相等.
③根据实验结果推测,铜与浓硝酸反应后溶液呈绿色的原因可能是反应生成的红棕色气体溶于生成的蓝色硝酸铜溶液.
④请另设计一个方案,验证你所得到的上述结论:方案一:取Cu与浓HNO3反应后的绿色溶液,向其中通入足量的空气(或氧气),溶液颜色由绿色逐渐变为蓝绿色,最终变为蓝色.
(2)乙组同学用足量浓硝酸和硫单质反应进行了实验探究.
假设硝酸的还原产物只有一种,乙组同学根据氧化还原反应推测硫的氧化产物,提出三种可能:I.只有硫酸;Ⅱ.只有二氧化硫;Ⅲ.二氧化硫和硫酸
乙组同学设计了下列实验,实验流程及步骤:

a.混合气体用水吸收后,测得无含硫、含氮物质逸出,并将吸收后的液体配成100.00mL溶液;
b.取a中所得溶液20.00mL,加入足量氯化钡溶液,得到0.466g白色沉淀;
c.再取20.00mLa中所得溶液,用氢氧化钠溶液中和,恰好用去0.6mol/L氢氧化钠溶液30.00mL.
请回答:
①二氧化氮和氧气的混合气体被水完全吸收的化学方程式为4NO2+O2+2H2O═4HNO3.
②步骤a中配制的100.00mL溶液中H+的物质的量浓度是0.9mol/L.
③该实验中收集到气体中含有NO2和SO2,假设III(填“I”“II”或“III”)成立.
④该实验中浓硝酸和硫反应的化学方程式为14HNO3(浓)+3S$\frac{\underline{\;△\;}}{\;}$2SO2↑+H2SO4+14NO2↑+6H2O.
15.以下表示重氢原子结构或核外电子运动状态的图式中一定错误的是( )
| A. |  | B. | $\stackrel{1}{2}$H | C. | 1s1 | D. |  |
12.下列物质中属于有机物的是( )
| A. | 甲烷 | B. | 苏打 | C. | 水泥 | D. | 玻璃 |