题目内容
6. 氮氧化物能造成光化学烟雾,引起大气污染,用以下方法可以消除.
氮氧化物能造成光化学烟雾,引起大气污染,用以下方法可以消除.Ⅰ.活性炭还原法处理氮氧化物.若向2L密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应生成甲和乙,甲和乙均为参与大气循环的物质,反应进行到不同时间测得各物质的物质的量浓度如下:
浓度(mol/L) 时间(min) | NO | 甲 | 乙 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
(2)T1℃时,该反应的平衡常数K=0.56(保留两位小数)
(3)30min时改变的条件是分离出乙.若30min后升高温度至T2,达到平衡时,容器中NO、甲、乙的浓度之比为2:1:1,则反应的△H<0(填“<”、“=”、“>”).
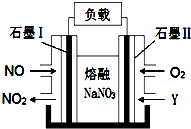
Ⅱ.以NO、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨电极Ⅰ生成NO2.
(4)石墨电极Ⅰ的反应式为NO2+NO3--e-=N2O5;为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,即必须在石墨电极Ⅱ电极处通入一种氧化物Y,Y是N2O5(填物质的化学式).
Ⅲ.CH4催化还原法.已知:
①CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(l)△H=-622kJ/mol
②CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(l)△H=-955kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
(5)写出CH4(g)与NO(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式CH4(g)+4NO(g)?2N2(g)+CO2(g)+2H2O(g)△H=-1200kJ/mol.
(6)恒容时,甲烷与二氧化氮在一定条件下只发生①反应,下列各项中能够判断该反应一定达平衡的是BC(填写正确选项的字母).
A.混合气体的总压强不改变
B.混合气体的相对分子质量不再改变
C.混合气体的密度不再改变
D.v(CH4)正=4v(NO)逆E.c(NO):c(CO2)=4:1.
分析 Ⅰ.(1)反应物为活性炭和NO,生成物甲和乙均为参与大气循环的物质,依此书写化学方程式;
(2)根据平衡常数的定义进行计算;
(3)根据表中数值知,NO、乙的浓度减小,甲的浓度增大,说明改变条件是分离出乙物质;
根据浓度比值的变化来确定移动方向;
Ⅱ.(4)燃料电池的负极上发生燃料失去电子的氧化反应;
Ⅲ.(5)根据盖斯定律进行计算,书写热化学方程式;
(6)恒容时,反应达到平衡的标志依据“变量不变”方向判断,正逆反应速率相同,各组分含量保持不变;
解答 解:Ⅰ.(1)反应物为活性炭和NO,生成物甲和乙均为参与大气循环的物质,故反应方程式为:C+2NO?N2+CO2,
故答案为:C+2NO?N2+CO2;
(2)20-30min时,各物质的物质的量不变,则该反应达到平衡状态,K=$\frac{c(CO{\;}_{2})•c(N{\;}_{2})}{c{\;}^{2}(NO)}$=$\frac{0.03×0.03}{0.04{\;}^{2}}$=0.56,
故答案为:0.56;
(3)根据表中数值知,NO、乙的浓度减小,甲的浓度增大,说明改变条件是分离出乙物质;
30min时,容器中NO、甲、乙的浓度之比=0.040:0.030:0.030=4:3:3,30min后升高温度至T2℃,达到平衡时,容器中NO、甲、乙的浓度之比为2:1:1,则平衡向逆反应方向移动,故正反应是放热反应,则△H<0,
故答案为:分离出乙;<;
Ⅱ.(4)燃料电池的负极上发生燃料失去电子的氧化反应,即NO-2e-+2NO3-═NO2+N2O5,负极生成N2O5,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,即必须在石墨电极Ⅱ电极处通入N2O5,
故答案为:NO2+NO3--e-=N2O5;N2O5;
Ⅲ.(5)①CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(l)△H=-622kJ/mol
②CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(l)△H=-955kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
由②×2-①-③×2得CH4(g)+4NO(g)?2N2(g)+CO2(g)+2H2O(g),△H=(-955)×2-(-622)-(-44)×2=-1200kJ/mol,
故答案为:CH4(g)+4NO(g)?2N2(g)+CO2(g)+2H2O(g)△H=-1200kJ/mol;
(6)恒容时,能判断该反应一定达到化学平衡状态的依据是正逆反应速率相同,个组分含量不变,对于反应CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(l),
A.该反应为前后气体体积不变,所以混合气体的总压强不改变,不能判断该反应是否处于平衡状态;
B.该反应为前后气体的物质的量不变,气体质量不守恒,所以混合气体的相对分子质量不再改变时,则说明反应已经处于平衡状态;
C.该反应为前后气体体积不变,气体质量不守恒,所以混合气体的密度不再改变时,则说明反应已经处于平衡状态;
D.当4v(CH4)正=v(NO)逆时,反应处于平衡状态,故D错误;
E.气体的浓度之比与起始量有关,与反应是否处于平衡状态无关,所以c(NO):c(CO2)=4:1,不能判断该反应是否处于平衡状态;
故选BC.
点评 本题考查斯定律的应用、化学平衡常数、化学平衡移动的影响因素、原电池等,原电池原理的应用和电极反应书写,难度中等.

 巧学巧练系列答案
巧学巧练系列答案| A. | NaCl晶体中混有少量Na2CO3 | B. | NaCl晶体中混有少量Na2SO4 | ||
| C. | NaCl晶体中混有少量CaCl2 | D. | NaCl晶体中混有少量Cu粉 |
| 化学式 | 电离常数 |
| HF | K=3.5×10-4 |
| H2CO3 | K1=4.3×10-7 |
| K2=5.6×10-11 | |
| HClO | K=3.2×10-8 |
| A. | 酸性强弱:KClO>H2CO3>HF | |
| B. | 同温同浓度下,溶液的pH值:NaF>NaClO>Na2CO3 | |
| C. | 次氯酸钠溶液中通少量二氧化碳的离子方程式:ClO-+CO2+H2O═HCO3-+HClO | |
| D. | 碳酸钠溶液中加入少量氢氟酸的离子方程式:CO${{\;}_{3}}^{2-}$+2HF═2F-+H2O+CO2↑ |
| A. | 达平衡后,甲、乙两容器中气体的密度相同 | |
| B. | 甲容器中反应达平衡所需时间比乙容器中的长 | |
| C. | 达平衡后,甲容器中混合气体的平均摩尔质量比乙容器中的大 | |
| D. | 平衡时甲容器中c(N2)=1 mol/L,若再充入1.5 mol N2和1 mol NH3,H2的转化率变大 |
(1)工业上生产氢气的反应为:CO(g)+H2O(g)?CO2(g)+H2(g).在t℃时,向1L密闭容器中充入0.2mol CO(g)和0.3molH2O(g).反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下CO的转化率为60%,反应的平衡常数K=1
(2)工业上合成NH3的反应为:N2(g)+3H2(g)?2NH3(g)△H<0,下表为不同温度下该反应的平衡常数.由此可推知,表中T1<573K(填“>”、“<”或“=”).工业实际生产中需通入过量的空气,其目的是增大氢气利用率
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol;
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol.
则CH4直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1.
| A. |  | B. | $\stackrel{1}{2}$H | C. | 1s1 | D. |  |