题目内容
7.从樟科植物枝叶提取的精油中含有下列甲、乙两种成分: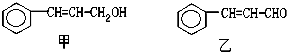
(1)乙中所含官能团的名称为醛基、碳碳双键
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
甲$→_{①}^{一定条件}$
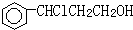 $\overrightarrow{②}$X $→_{③△}^{NaOH醇溶液}$乙
$\overrightarrow{②}$X $→_{③△}^{NaOH醇溶液}$乙设计步骤①的目的是保护碳碳双键,反应②的化学方程式为
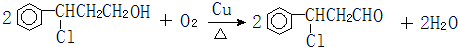 (注明反应条件).
(注明反应条件).(3)欲检验乙中的含氧官能团,选用下列的一种试剂是D(填序号).
A.溴水 B.酸性高锰酸钾溶液 C.溴的CCl4溶液 D.银氨溶液
(4)乙经氢化和氧化得到丙(
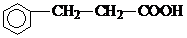 ).写出同时符合①能发生银镜反应;②能与FeCl3溶液发生显色反应;③核磁共振氢谱图上产生4个吸收峰等要求的丙的同分异构体结构简式
).写出同时符合①能发生银镜反应;②能与FeCl3溶液发生显色反应;③核磁共振氢谱图上产生4个吸收峰等要求的丙的同分异构体结构简式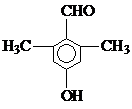 、
、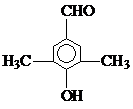 .
.
分析 (1)乙中官能团是醛基、碳碳双键;
(2)甲和HCl发生加成反应生成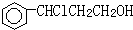 ,
,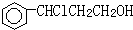 发生催化氧化生成-CHO,X发生消去反应生成乙;
发生催化氧化生成-CHO,X发生消去反应生成乙;
(3)乙中含氧官能团是醛基,醛基能被强氧化剂、弱氧化剂氧化,碳碳双键能被强氧化剂氧化,能和溴发生加成反应;
(4)丙的同分异构体符合下列条件:①能发生银镜反应说明含有醛基;②能与FeCl3溶液发生显色反应说明含有酚羟基;③核磁共振氢谱图上产生4个吸收峰,说明含有四种氢原子.
解答 解:(1)乙中官能团是醛基、碳碳双键,故答案为:醛基、碳碳双键;
(2)甲和HCl发生加成反应生成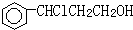 ,
,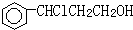 发生催化氧化生成-CHO,X发生消去反应生成乙;
发生催化氧化生成-CHO,X发生消去反应生成乙;
碳碳双键易被氧化,所以①的目的是保护碳碳双键;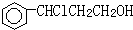 发生催化氧化生成-CHO,反应方程式为
发生催化氧化生成-CHO,反应方程式为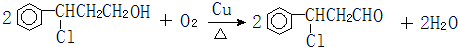 ,
,
故答案为:保护碳碳双键;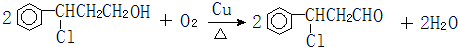 ;
;
(3)乙中含氧官能团是醛基,醛基能被强氧化剂、弱氧化剂氧化,碳碳双键能被强氧化剂氧化,能和溴发生加成反应,要检验醛基,应该排除碳碳双键的干扰,用银氨溶液检验,故选D;
(4)丙的同分异构体符合下列条件:①能发生银镜反应说明含有醛基;②能与FeCl3溶液发生显色反应说明含有酚羟基;③核磁共振氢谱图上产生4个吸收峰,说明含有四种氢原子,符合条件的结构简式为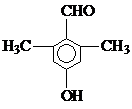
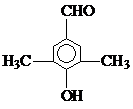
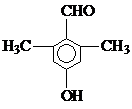
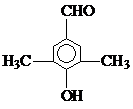
点评 本题考查有机物推断及有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,注意结合反应条件推断物质,难点是同分异构体种类判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.2,3,4-三甲基戊烷的一氯代物可能有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
12.氮元素的单质和常见的化合物在工、农业生产中用途广泛.
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是N2.
(2)雷雨时空气中的N2转化为NO,生成物NO是无色的气体,难(填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应.NO2与水反应的化学方程式为3NO2+H2O=2HNO3+NO.
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气.
①制取氨气的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;加热\;}}{\;}$CaCl2+2H2O+2NH3↑;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为10.7g.
(4)已知:4NH3+6NO$\frac{\underline{\;催化剂\;}}{\;}$5N2+6H2O.化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能.

若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同).
①NH3与稀硫酸溶液反应的离子方程式为NH3+H+=NH4+;;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是溶液显色所需时间.
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
| N2 | O2 | Ar | CO2 |
| -196°C | -183°C | -186°C | -78°C |
(2)雷雨时空气中的N2转化为NO,生成物NO是无色的气体,难(填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应.NO2与水反应的化学方程式为3NO2+H2O=2HNO3+NO.
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气.
①制取氨气的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;加热\;}}{\;}$CaCl2+2H2O+2NH3↑;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为10.7g.
(4)已知:4NH3+6NO$\frac{\underline{\;催化剂\;}}{\;}$5N2+6H2O.化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能.

若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同).
①NH3与稀硫酸溶液反应的离子方程式为NH3+H+=NH4+;;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是溶液显色所需时间.
19.下述实验方案能达到实验目的是( )
| A. |  验证铁钉发生吸氧腐蚀 | |
| B. | 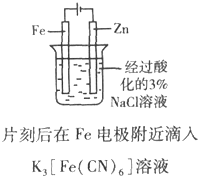 证明Fe电极被保护 | |
| C. | 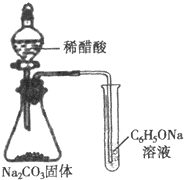 酸性强弱顺序为CH3COOH>H2CO3>C6H5OH | |
| D. | 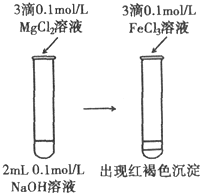 溶解度:Mg(OH)2>Fe(OH)3 |
16.已知某有机物9.2g与足量氧气在密闭容器中完全燃烧后,将反应生成的气体依次通过浓硫酸和碱石灰.浓硫酸增重10.8g,碱石灰增重17.6g,该有机物的化学式是( )
| A. | CH4O | B. | C2H4O | C. | C2H6O | D. | C2H6O2 |
 研究工业废弃物的处理和防治具有重要的意义.
研究工业废弃物的处理和防治具有重要的意义. .A的一种晶体的晶胞如图1甲,乙图中
.A的一种晶体的晶胞如图1甲,乙图中 和
和 表示的是同种原子,即乙是8个甲无隙并置的结果,若按甲图中虚线方向切乙,得到图2的a~d,图中正确的是a.
表示的是同种原子,即乙是8个甲无隙并置的结果,若按甲图中虚线方向切乙,得到图2的a~d,图中正确的是a.
 . 据报道,只含镁、C和D三种元素的晶体竟然具有超导性.该晶体的结构(如图3示)可看作由镁原子和C原子在一起进行面心立方密堆积,该晶体的化学式为MgCNi3.晶体中每个
. 据报道,只含镁、C和D三种元素的晶体竟然具有超导性.该晶体的结构(如图3示)可看作由镁原子和C原子在一起进行面心立方密堆积,该晶体的化学式为MgCNi3.晶体中每个 原子周围距离最近的
原子周围距离最近的 原子有12个.
原子有12个.
