题目内容
8.CuCl2、CuCl是重要的化工原料,广泛地用作有机合成催化剂.实验室中以粗铜(含杂质Fe)为原料,一种制备铜的氯化物的流程如下: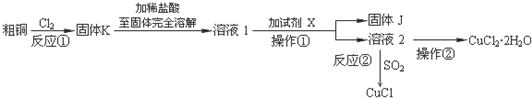
(1)上述流程中固体K溶于稀盐酸的目的是防止Cu2+水解.试剂X、固体J的物质分别为B.
A.NaOH Fe(OH)3B.CuO Fe(OH)3
C.NH3•H2O Fe(OH)2 D.CuSO4 Cu(OH)2
(2)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀.写出制备CuCl的离子方程式2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-.
(3)以石墨为电极,电解CuCl2溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式Cu2++e-+Cl-=CuCl.
分析 粗铜(含杂质Fe)与氯气反应生成氯化铁和氯化铜,加稀盐酸溶解,形成氯化铁和氯化铜溶液,再加试剂x为CuO或氢氧化铜等调节pH,使铁离子转化为氢氧化铁沉淀,过滤得到的固体J为氢氧化铁,溶液2为氯化铜溶液,通入二氧化硫,二氧化硫与铜离子发生氧化还原反应生成CuCl,氯化铜溶液在HCl氛围中蒸发结晶得到CuCl2•2H2O;
(1)流程中固体K溶于稀盐酸的目的是防止铜离子水解,试剂X、固体J的物质分别为氧化铜,氢氧化铁,根据从溶液中提取溶质晶体的操作分析;
(2)根据信息可知:SO2与铜离子反应生成CuCl白色沉淀和SO42-;
(3)阴极上是得到电子发生还原反应,Cu2+得到电子生成CuCl,结合电荷守恒配平书写电极反应.
解答 解:粗铜(含杂质Fe)与氯气反应生成氯化铁和氯化铜,加稀盐酸溶解,形成氯化铁和氯化铜溶液,再加CuO或氢氧化铜等调节pH,使铁离子转化为氢氧化铁沉淀,过滤得到的固体2为氢氧化铁,溶液2为氯化铜溶液,通入二氧化硫,二氧化硫与铜离子发生氧化还原反应生成CuCl,氯化铜溶液在HCl氛围中蒸发结晶得到CuCl2•2H2O;
(1)流程中固体K溶于稀盐酸的目的是防止铜离子水解,试剂X、固体J的物质分别为氧化铜,氢氧化铁,选B,
故答案为:防止Cu2+水解;冷却结晶,B;
(2)根据信息可知:在加热条件下,SO2与铜离子反应生成CuCl白色沉淀和SO42-,其反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-;
故答案为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-;
(3)以石墨为电极,电解CuCl2溶液时发现阴极上也会有部分CuCl析出,阴极上是得到电子发生还原反应,Cu2+得到电子生成CuCl,电极反应为:Cu2++e-+Cl-=CuCl,
故答案为:Cu2++e-+Cl-=CuCl.
点评 本题以实验室制备氯化铜为背景,考查了物质的制备实验操作、离子检验、除杂质、离子方程式的书写、原电池原理的应用等,题目涉及的知识点较多,侧重于基础知识的综合应用的考查,难度中等.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案| A. | HI、H2、I2的浓度相等且不再改变时 | B. | 混合气体的颜色深浅不再变化时 | ||
| C. | 混合气体的平均摩尔质量不变时 | D. | v(HI):v(H2):v(I2)=2:1:1时 |
①4Au+8NaCN+O2+2H2O═4Na[Au(CN)2]+4NaOH
②2Na[Au(CN)2]+Zn═2Au+Na2[An(CN)4]
以下有关氰化法提炼金的说法中正确的是( )
| A. | Na[Au(CN)2]可溶于水 | |
| B. | 化合物Na[Au(CN)2]中金元素的化合价为+2 | |
| C. | 金化学性质稳定,不与任何物质反应 | |
| D. | 在提炼过程中含金元素的物质始终作氧化剂 |
| A. | 200mL含9.5g MgCl2的溶液 | |
| B. | 31g Na2O溶于水配成1L溶液 | |
| C. | 4%的H2SO4溶液(ρ=1.025g•cm-3) | |
| D. | 213mL 0.5mol•L-1盐酸和82mL 0.5mol•L-1盐酸的混合液 |
(1)硫酸生产过程中涉及以下反应.已知25℃、l0l kPa时:
2SO2(g)+O2(g)+2H2O(l)═2H2SO4(l)△H=-457kJ•mol-1
SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ•mol-1
则SO2催化氧化反应中,每生成l mol SO3(g)的焓变为-98.5kJ•mol-1
(2)对于SO3催化氧化反应:2SO2(g)+O2(g)?2SO3(g).
①甲图是SO2催化氧化反应时SO2(g)和SO3(g)的浓度随时间的变化情况.反应从开始到达到平衡时,用O2表示的平均反应速率为0.0375mol/(L.min).

②在一容积可变的密闭容器中充入20molSO2(g)和l0molO2(g),O2的平衡转化率随温度(T)、压强(P)的变化如图乙所示.则P1与P2的大小关系是P1< P2(填>、=或<);A、B、C三点的平衡常数大小关系是KA=KB>KC(用KA、KB、KC和>、=、<表示).
(3)为研究H2SO4生产中SO3催化氧化时温度对SO2平衡转化率的影响,进行如下试验.取100L原料气(体积分数为SO27%、O2 11%、N282%)使之发生反应,在10l kPa下达到平衡,得到如下数据:
| 温度/℃ | 500 | 525 | 550 | 575 | 600 |
| 平衡转化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
(4)工业生成硫酸过程中,通常用氨水吸收尾气.
①如果相同物质的量的SO2与NH3溶于水,发生反应的离子方程式为SO2+NH3+H2O=NH4++HSO3-,所得溶液中c(H+)-c(OH-)=cd(填序号).
a.c(SO32-)-c(H2SO3)
b.c(HSO3-)+c(SO32-)-c(NH4+)
c.c(SO32-)+c(NH3•H2O)-c(H2SO3)
d.c(HSO3-)+2c(SO32-)-c(NH4+)
②工业上用足量氨水吸收硫酸工业废气.吸收SO2后的碱性溶液还可用于Cl2的尾气处理,吸收Cl2后的溶液仍呈强碱性,则吸收Cl2后的溶液中一定存在的阴离子有OH-和Cl-、SO42-.
实验内容:铜与硝酸反应有关问题的探讨.
实验器材:电线细铜丝,1mol•L-1HNO3,14mol•L-1HNO3,碱石灰,Cu(NO3)2晶体,玻璃丝,酒精灯,试管,夹持器械,火柴.实验记录如下.
| 步骤 | 实验操作 | 现象记录 |
| 1 | 将1g细铜丝放入盛有10mL1mol•L-1HNO3的试管中加热 | 铜丝表面有无色气体逸出,溶液变成天蓝色 |
| 2 | 将1g细铜丝放入盛有10mL的14mol•L-1HNO3的试管中 | 产生大量红棕色气体,溶液变为绿色,绿色由深到浅,未见到蓝色. |
| 3 | 将硝酸铜晶体配成饱和溶液 | 深蓝色溶液 |
| 4 | 向饱和的硝酸铜溶液中不断滴加14mol•L-1HNO3 | 溶液仍呈深蓝色 |
请回答:
(1)稀硝酸与铜丝反应后,所得溶液呈天蓝色的化学粒子符号是[Cu(H2O)4]2+(写化学式).
(2)使饱和硝酸铜溶液呈深蓝色的化学粒子符号可能是[Cu(H2O)4-x(NO3)x](2-x)(1<x<4).
(3)有资料上介绍浓硝酸与铜丝反应后所得溶液颜色显蓝色,实验中得到却是绿色溶液,试写出显绿色的可能原因可能是还原产物NO2溶入其中引起的,设计两种不同的简单的实验方法证明你的解释:方案①向饱和的硝酸铜溶液中通入大量的NO2气体;方案②将浓硝酸与铜丝反应后的溶液加热(或方案③用水稀释).
| A. | 标准状况下,11.2L己烷中含有分子的数目为0.5NA | |
| B. | 1mol/L CH3COOH溶液中含有CH3COOH分子的数目为NA | |
| C. | 78g 苯中含有碳碳双键的数目为3NA | |
| D. | 10g46%的乙醇水溶液中所含氢原子数目为1.2NA |
 研究工业废弃物的处理和防治具有重要的意义.
研究工业废弃物的处理和防治具有重要的意义. .A的一种晶体的晶胞如图1甲,乙图中
.A的一种晶体的晶胞如图1甲,乙图中 和
和 表示的是同种原子,即乙是8个甲无隙并置的结果,若按甲图中虚线方向切乙,得到图2的a~d,图中正确的是a.
表示的是同种原子,即乙是8个甲无隙并置的结果,若按甲图中虚线方向切乙,得到图2的a~d,图中正确的是a.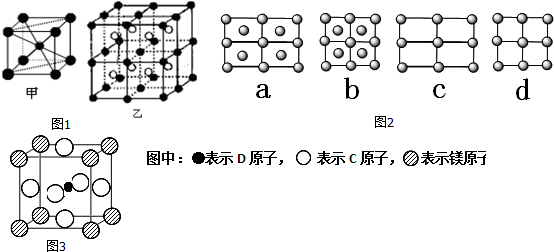
 . 据报道,只含镁、C和D三种元素的晶体竟然具有超导性.该晶体的结构(如图3示)可看作由镁原子和C原子在一起进行面心立方密堆积,该晶体的化学式为MgCNi3.晶体中每个
. 据报道,只含镁、C和D三种元素的晶体竟然具有超导性.该晶体的结构(如图3示)可看作由镁原子和C原子在一起进行面心立方密堆积,该晶体的化学式为MgCNi3.晶体中每个 原子周围距离最近的
原子周围距离最近的 原子有12个.
原子有12个.