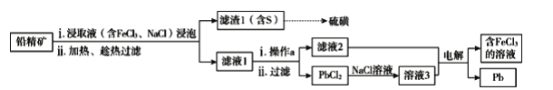
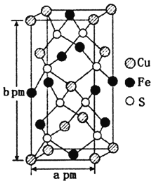
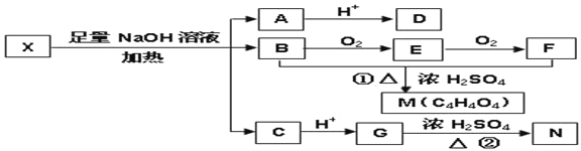
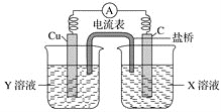
题目内容
【题目】下列有关反应热的叙述中正确的是 ( )
①已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ· mol-1,则氢气的燃烧热ΔH=-241.8 kJ· mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)![]() Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
④已知:下表数据可以计算出![]() (g)+3H2(g)
(g)+3H2(g)![]()
![]() (g)的焓变
(g)的焓变
共价键 | C—C | C=C | C—H | H—H |
键能/(kJ·mol-1) | 348 | 610 | 413 | 436 |
⑤根据盖斯定律可推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2(g)时,放出的热量相等
⑥25 ℃、101 kPa时,1 mol碳完全燃烧生成CO2(g)所放出的热量为碳的燃烧热
A.①②③④B.③④⑤C.④⑤D.⑥
【答案】D
【解析】
①燃烧热概念中生成的H2O应是液态,故①错误;
②A→B是吸热过程,说明A具有的能量比B低,能量越低越稳定,则A比B稳定,故②错误;
③△H只跟始态和终态有关,代表1molX完全反应后产生的热效应,平衡后加入X后△H不变,故③错误;
④由于苯环中的碳碳键是介于单键和双键之间特殊的键,题目中没有说明键能是多少,无法计算反应 的焓变,故④错误;
的焓变,故④错误;
⑤金刚石和石墨的结构不同,所具有的能量不同,燃烧生成1molCO2气体时放出的热量是不同的,故⑤错误;
⑥25℃101kPa时,1mol碳完全燃烧生成CO2气体所放出的热量为碳的燃烧热,该说法合理,故⑥正确;
只有⑥正确,故选D。

【题目】(1)t1 ℃时,密闭容器中,通入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位: mol·L-1)变化如下表所示:
CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位: mol·L-1)变化如下表所示:
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①一定处于平衡状态的时间段为____________。
②5~6 min时间段内,平衡移动方向为_______________ (填“向左移动”或“向右移动”),根据表中数据判断,平衡移动的原因是________(填字母编号)。
a.增加了H2O(g)的量 b.增加氢气浓度 c.使用催化剂 d.降低温度
③t2 ℃时(t2>t1),在相同条件下发生上述反应,达平衡时,CO浓度________c1(填“>”“<”或“=”)。
(2)已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数随温度变化情况如图所示:
FeO(s)+CO(g)的平衡常数随温度变化情况如图所示:
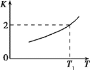
①用CO还原FeO制备Fe的反应是___________ (填“吸热”或“放热”)反应。
②温度为T2时,实验测得该反应体系中CO浓度为CO2的2.5倍,则T2______T1(填“>”“<”或“=”)。
(3)工业上常用CO、CO2和H2合成甲醇燃料,其原理为:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH<0;②CO2(g)+H2(g)
CH3OH(g) ΔH<0;②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
当混合气体的组成固定时,CO平衡转化率(α)与温度和压强的关系如图所示。
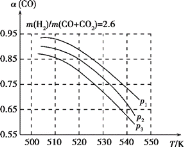
图中的压强由大到小的顺序为____________,判断理由是_________________________;
试解释CO平衡转化率随温度升高而减小的原因是_______________________。