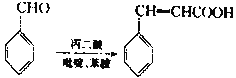
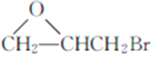
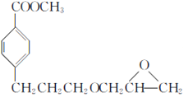题目内容
【题目】将有机物完全燃烧,生成CO2和H2O,将12 g该有机物完全燃烧产物通过浓硫酸,浓硫酸增重14.4 g,再通过碱石灰,又增重26.4 g。则该有机物的分子式为( )
A. C4H10 B. C2H6O
C. C3H8O D. C2H4O2
【答案】C
【解析】
浓硫酸增重14.4 g,即水的质量为14.4 g,根据公式n = ![]() 计算得出水的物质的量为0.8 mol;通过碱石灰,又增重26.4 g同理计算得出二氧化碳的物质的量为0.6 mol,结合元素守恒法计算得出有机物中O元素的质量,进而可知有机物中C、H、O元素的物质的量,最后确定有机物的分子式。
计算得出水的物质的量为0.8 mol;通过碱石灰,又增重26.4 g同理计算得出二氧化碳的物质的量为0.6 mol,结合元素守恒法计算得出有机物中O元素的质量,进而可知有机物中C、H、O元素的物质的量,最后确定有机物的分子式。
浓硫酸增重可知水的质量为14.4 g,可计算出n(H2O) = ![]() = 0.8 mol,n(H) =1.6 mol,m(H) = 1.6 g;使碱石灰增重26.4 g,可知二氧化碳质量为26.4 g,n(C) = n(CO2) =
= 0.8 mol,n(H) =1.6 mol,m(H) = 1.6 g;使碱石灰增重26.4 g,可知二氧化碳质量为26.4 g,n(C) = n(CO2) = ![]() = 0.6 mol,m(C) = 7.2 g;m(C)+m(H) = 8.8 g,有机物的质量为12 g,所以有机物中氧的质量为3.2 g,n(O) =
= 0.6 mol,m(C) = 7.2 g;m(C)+m(H) = 8.8 g,有机物的质量为12 g,所以有机物中氧的质量为3.2 g,n(O) =![]() = 0.2 mol;n(C):n(H):n(O) = 0.6 mol:1.6mol:0.2mol = 3:8:1,即实验式为C3H8O,由于C3H8O中碳原子已经饱和,所以分子式也为C3H8O,故C项正确;
= 0.2 mol;n(C):n(H):n(O) = 0.6 mol:1.6mol:0.2mol = 3:8:1,即实验式为C3H8O,由于C3H8O中碳原子已经饱和,所以分子式也为C3H8O,故C项正确;
答案选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目