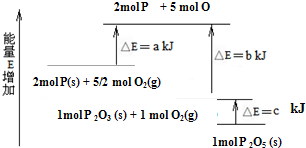
题目内容
6.以下除杂方案不正确的是( )| A. | Cl2中混有HCl,可依次通入盛有饱和食盐水、浓H2SO4的洗气瓶 | |
| B. | NH4Cl 溶液中混有Fe3+,可加入NaOH溶液后过滤 | |
| C. | CO中混有CO2,可依次通入盛NaOH 溶液、浓 H2SO4的洗气瓶 | |
| D. | Na2CO3固体中混有NaHCO3,可用灼烧的方法除尽 |
分析 A.HCl极易溶于水,浓硫酸可干燥氯气;
B.氯化铵、铁离子均与NaOH溶液反应;
C.二氧化碳与NaOH溶液反应,而CO不能,浓硫酸可干燥CO;
D.碳酸氢钠加热分解生成碳酸钠.
解答 解:A.HCl极易溶于水,浓硫酸可干燥氯气,则依次通入盛有饱和食盐水、浓H2SO4的洗气瓶可除杂,故A正确;
B.氯化铵、铁离子均与NaOH溶液反应,不能除杂,应选择氨水、过滤可除杂,故B错误;
C.二氧化碳与NaOH溶液反应,而CO不能,浓硫酸可干燥CO,则依次通入盛NaOH 溶液、浓 H2SO4的洗气瓶可除杂,故C正确;
D.碳酸氢钠加热分解生成碳酸钠,则用灼烧的方法除尽,故D正确;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应、混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
16.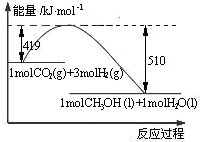 5、常温下,反应CO2(g)+3H2(g)?CH3OH(l)+H2O(l)的能量变化如图所示.反应达到平衡后,要使该反应化学平衡向右移动,其他条件不变,可采取的措施是( )
5、常温下,反应CO2(g)+3H2(g)?CH3OH(l)+H2O(l)的能量变化如图所示.反应达到平衡后,要使该反应化学平衡向右移动,其他条件不变,可采取的措施是( )
 5、常温下,反应CO2(g)+3H2(g)?CH3OH(l)+H2O(l)的能量变化如图所示.反应达到平衡后,要使该反应化学平衡向右移动,其他条件不变,可采取的措施是( )
5、常温下,反应CO2(g)+3H2(g)?CH3OH(l)+H2O(l)的能量变化如图所示.反应达到平衡后,要使该反应化学平衡向右移动,其他条件不变,可采取的措施是( )| A. | 升高温度 | B. | 分离出甲醇 | ||
| C. | 缩小反应器体积 | D. | 使用合适的催化剂 |
17.下列物质分子中有最多原子在一条直线上的是( )
| A. | 乙醇 | B. | 乙烯 | C. | 乙烷 | D. | 苯 |
14.电解100mL含c(H+)=0.30mol/L的下列各溶液,当电路中通过0.04mol电子时,理论上获得的阴极产物物质的量最大的是( )
| A. | 0.20 mol/L Ag+ | B. | 0.20 mol/L Al3+ | C. | 0.20 mol/L Cu2+ | D. | 0.20 mol/L Mg2+ |
1.等物质的量浓度的下列稀溶液:①CH3COONa溶液;②NaHCO3溶液;③X溶液;④Ba(OH)2溶液.它们的pH依次增大,则X溶液不可能是( )
| A. | Na2CO3溶液 | B. | Na2SiO3溶液 | C. | NaOH溶液 | D. | NaHSO3溶液、 |
11.已知16S和34Se位于同一主族,下列说法正确的是( )
| A. | 热稳定性:H2Se>H2S>H2O | B. | 原子半径:Se>Cl>S | ||
| C. | 酸性:H2SeO4<H2SO4<HClO4 | D. | 还原性:S2->Se2->Br- |
18. 已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )
 已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )| A. | 0~b间的反应可用离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+ | |
| B. | a点时消耗NaHSO3的物质的量为1.2 mol | |
| C. | b点到c点,KIO3与NaHSO3反应生成I2 | |
| D. | 当溶液中I-与I2的物质的量之比为5:2,加入的KIO3为1.08 mol |
16.甲烷和水反应可以制水煤气(混合气体),其反应的微观示意图如图所示,根据以上微观示意图得出的结论中,正确的是( )


| A. | 反应前后各元素的化合价均不变 | |
| B. | 水煤气的成分是一氧化碳和氧气 | |
| C. | 该反应中含氢元素的化合物有3种 | |
| D. | 该反应的化学方程式中甲烷和水的计量数之比为1:1 |