题目内容
7.实验室配制450mL1.0mol?L-1 NaOH溶液,下列有关说法正确的是( )| A. | 应用托盘天平称取20g NaOH固体 | |
| B. | 配制过程中所用玻璃棒的作用是搅拌和引流 | |
| C. | NaOH固体在烧杯中称量时间过长,所配NaOH溶液的浓度偏大 | |
| D. | 定容摇匀后,发现液面下降,继续加水至刻度线,对所配NaOH溶液的浓度无影响 |
分析 A.根据公式m=M•n=cvM来计算物质的质量,天平的精确度为0.1g;
B.依据配制过程中玻璃棒的作用解答;
C.氢氧化钠容易吸收空气中的水、二氧化碳;
D.定容摇匀后,发现液面下降,继续加水至刻度线,导致溶液的体积偏大.
解答 解:A.配制450mL1.0mol?L-1 NaOH溶液,需要氢氧化钠的质量m=M•n=cVM=1.0mol/L×0.5L×40/mol=20.0g,故A错误;
B.稀释时玻璃棒起搅拌作用,转移液体时起引流作用,故B正确;
C.氢氧化钠容易吸收空气中的水、二氧化碳,称量时间过长,所取氢氧化钠的物质的量偏小,所配NaOH溶液的浓度偏小,故C错误;
D.定容摇匀后,发现液面下降,继续加水至刻度线,导致溶液的体积偏大,溶液的物质的量浓度偏小,故D错误;
故选:B.
点评 本题考查了一定物质的量浓度溶液的配制,熟悉配制过程是解题关键,注意依据C=$\frac{n}{V}$进行误差分析,题目不大.

练习册系列答案
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
17.下列说法正确的是( )
| A. | 可以用澄清的石灰水鉴别SO2和CO2 | |
| B. | SO2能使溴水、KMnO4溶液迅速褪色 | |
| C. | 硫粉在过量的氧气中燃烧可得到SO3 | |
| D. | 少量SO2通入到浓的CaCl2溶液能生成白色沉淀 |
18.下列有关化学用语正确的是( )
| A. | 乙醇、乙二醇、丙三醇互为同系物,同系物之间不可能为同分异物体 | |
| B. | 北京奥运会奖牌--“金镶玉”奖牌玉的化学成分多为含水钙镁硅酸盐,如:Ca2Mg5Si8O22(OH)2可用氧化物表示为:2CaO•5MgO•8SiO2•H2O | |
| C. | 次氯酸的结构式为:H-Cl-O | |
| D. | 丙烷分子的比例模型示意图: |
15.加强空气质量检测,客观分析空气中污染物的来源及性质,将有助于制定有针对性的治理措施.下表是某城市某日的空气质量报告:
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行了如下探究:
(1)用下图所示装置进行实验.
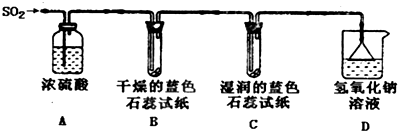
①A装置的作用是干燥.
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变成红色,说明SO2与水反应生成一种酸,其化学反应方程式是S02+H20?H2S03.
③D装置的作用是吸收多余SO2气体,避免污染空气,
D中发生反应的化学方程式是S02+2NaOH=Na2S03+H20.
(2)往盛有水的烧杯中通入SO2气体,测得所得溶液的pH<7(填“>”“=”或“<”),然后每隔1h测定其pH,发现pH逐渐变小(填“变大”或“变小”),直至恒定,原因是2H2SO3+O2=4H++2SO42-(写出反应的离子方程式).
(3)SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4,则在此过程中的飘尘是作为催化剂(填“催化剂”或“氧化剂”).
(4)SO2与空气中的氧气、水反应生成硫酸而形成酸雨.该市可能易出现酸雨.汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为HNO3,是造成酸雨的另一主要原因.
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | SO2 | II | 良 |
(1)用下图所示装置进行实验.

①A装置的作用是干燥.
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变成红色,说明SO2与水反应生成一种酸,其化学反应方程式是S02+H20?H2S03.
③D装置的作用是吸收多余SO2气体,避免污染空气,
D中发生反应的化学方程式是S02+2NaOH=Na2S03+H20.
(2)往盛有水的烧杯中通入SO2气体,测得所得溶液的pH<7(填“>”“=”或“<”),然后每隔1h测定其pH,发现pH逐渐变小(填“变大”或“变小”),直至恒定,原因是2H2SO3+O2=4H++2SO42-(写出反应的离子方程式).
(3)SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4,则在此过程中的飘尘是作为催化剂(填“催化剂”或“氧化剂”).
(4)SO2与空气中的氧气、水反应生成硫酸而形成酸雨.该市可能易出现酸雨.汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为HNO3,是造成酸雨的另一主要原因.
2.可逆反应达到化学平衡的标志是( )
| A. | 正、逆反应不再进行 | B. | 反应物的浓度为零 | ||
| C. | 反应物的浓度与生成物的浓度相等 | D. | 正、逆反应的速率相等 |
19.500ml 2mol/L的MgCl2溶液中含有氯离子的物质的量是( )
| A. | 1 mol | B. | 2 mol | C. | 3 mol | D. | 1000 mol |
16.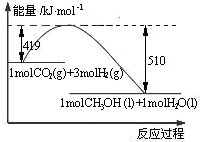 5、常温下,反应CO2(g)+3H2(g)?CH3OH(l)+H2O(l)的能量变化如图所示.反应达到平衡后,要使该反应化学平衡向右移动,其他条件不变,可采取的措施是( )
5、常温下,反应CO2(g)+3H2(g)?CH3OH(l)+H2O(l)的能量变化如图所示.反应达到平衡后,要使该反应化学平衡向右移动,其他条件不变,可采取的措施是( )
 5、常温下,反应CO2(g)+3H2(g)?CH3OH(l)+H2O(l)的能量变化如图所示.反应达到平衡后,要使该反应化学平衡向右移动,其他条件不变,可采取的措施是( )
5、常温下,反应CO2(g)+3H2(g)?CH3OH(l)+H2O(l)的能量变化如图所示.反应达到平衡后,要使该反应化学平衡向右移动,其他条件不变,可采取的措施是( )| A. | 升高温度 | B. | 分离出甲醇 | ||
| C. | 缩小反应器体积 | D. | 使用合适的催化剂 |
17.下列物质分子中有最多原子在一条直线上的是( )
| A. | 乙醇 | B. | 乙烯 | C. | 乙烷 | D. | 苯 |
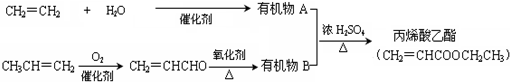
 ,反应类型是加聚反应.
,反应类型是加聚反应.